基本介紹
- 中文名:人工肝
- 外文名: Artificial extracorporeal liver support
- 全稱:人工肝臟
- 開始研究:20世紀50年代
人工肝簡介
 人工肝
人工肝人工肝技術
血液灌流
 人工肝
人工肝血漿置換
血漿置換的缺點
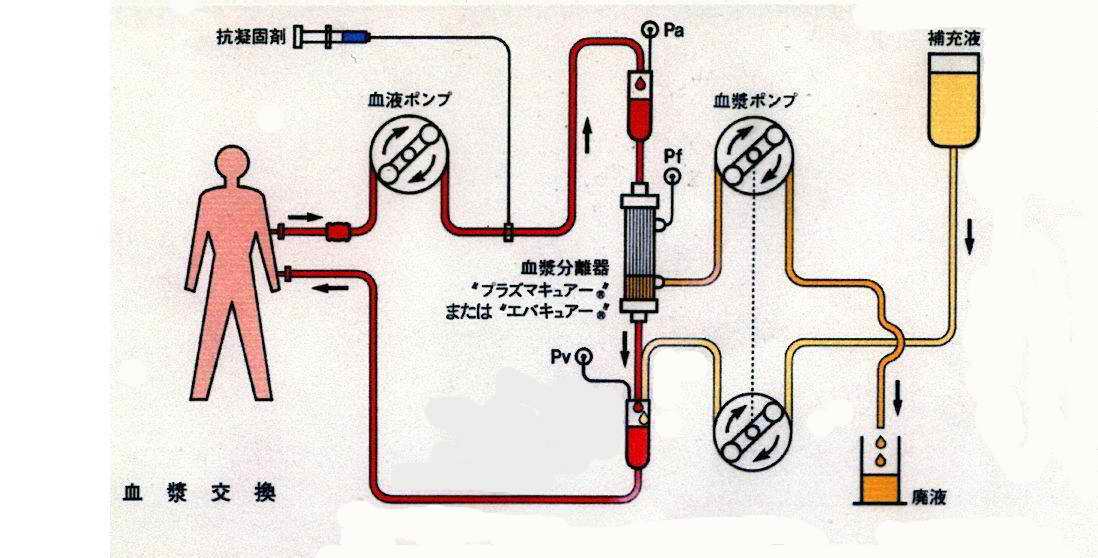 血漿置換
血漿置換連續性血液淨化技術
 人工肝
人工肝研究現狀
分子吸附再循環系統
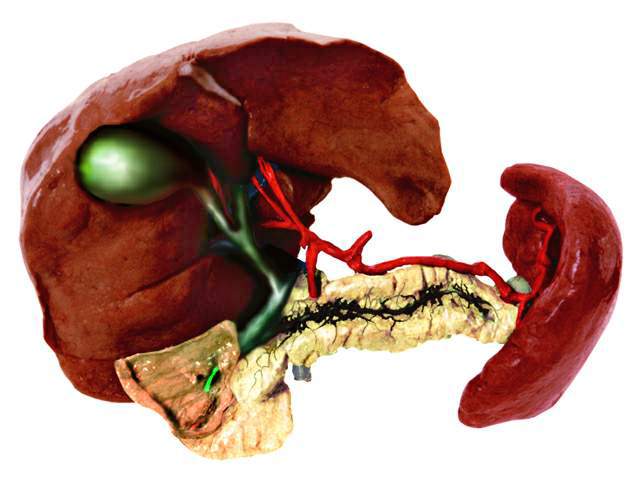 人工肝
人工肝生物型或組合生物型人工肝
研究歷史
國內現狀
 人工肝樣機
人工肝樣機
 人工肝
人工肝 人工肝
人工肝 血漿置換
血漿置換 人工肝
人工肝 人工肝
人工肝 人工肝樣機
人工肝樣機人工肝臟簡稱為人工肝,英文名稱 Artificial extracorporeal liver support,它作為獨立於其人工器官而存在的歷史並不長。人工肝的研究始於20世紀50年代,1956年Sorrentino...
人工肝技術,即人工肝血液淨化技術,是指血漿置換和血液吸附技術,即溶解在血液中致炎物質或毒素被吸附到具有豐富表面積的固態物質上藉以從血液中清除炎症物質和毒物。...
簡介由各種原因引起的肝臟疾病,例如各型病毒性肝炎、藥物性肝炎、酒精性肝炎、中毒性肝損害、代謝性肝病等均表現為不同程度的肝功能障礙。當大部分肝細胞變性、壞死...
人工肝支持(artificial liver support)是幫助機體清除因急性肝功衰竭而在體內積蓄的有毒物質的人工裝置,又稱人工肝輔助器。...
人工肝是目前治療肝衰竭不可或缺的重要手段,通過體外的一個理化或生物裝置暫時性替代肝臟功能,清除體內有毒物質,代償肝臟生理功能,從而使得肝細胞得以再生直至自體...
各種急、慢性因素損害肝臟,導致肝細胞數量急劇減少,肝臟合成功能障礙,體內各種有毒物質得不到及時清除,從而導致肝功能衰竭及全身器官功能受損,危及生命。人工肝是為...
當受到多種因素(如病毒、酒精、藥物等)引起嚴重損害時,造成肝細胞大量壞死,導致上述功能發生嚴重障礙或失代償,進而出現以凝血機制障礙和黃疸、肝性腦病、腹水等為...
由各種原因引起的肝臟疾病,例如各型病毒性肝炎、藥物性肝炎、酒精性肝炎、中毒性肝損害、代謝性肝病等均表現為不同程度的肝功能障礙。當大部分肝細胞變性、壞死,...
人工肛門,又稱人造肛門,或腸造口,腸造瘺,即通過手術使大便改道,不再從肛門排出。人工肛門多見於低位直腸癌根治術後、結直腸癌術後臨時造口、腸梗阻患者為解除腸道...
《實用人工肝及血液淨化操作手冊》是北京大學出版社出版的圖書,ISBN是9787506732475。...
李蘭娟,女,1947年9月13日出生於浙江紹興,感染病(傳染病)學家、中國人工肝開拓者、國家傳染病重點學科帶頭人,中國工程院院士,浙江大學醫學部教授、博士生導師,浙江...
近年來,施曉雷在肝膽腫瘤、肝移植領域臨床和基礎研究深入,研究在國內處於前沿。率先攻克生物人工肝用大規模培養細胞和生物反應器的難題,完成了生物人工肝的研發,獲...
所謂“人造肝臟”就是一套體外循環裝置,病人血液在體外流動過程中得到淨化、解毒並補充進去有益成分,實際上是代替了肝臟的一些功能,幫了肝臟的忙,因此習慣上把人工...
徐小微,女,副主任醫師,1969年5月7日出生。擅長人工肝治療,病毒性肝炎的治療。從事傳染病臨床教學科研工作10餘年,有較紮實的專業知識和臨床實踐能力。1998年起加入...
甘建和,1958年9月出生、江西樂平人。甘建和從事傳染病、肝病臨床研究,擅長中西醫結合治療重型肝炎/肝衰竭、肝硬化、慢性肝病及各種急性傳染病診治。甘建和承擔並負責省...
現擔任上海交通大學附屬第六人民醫院腎臟風濕科主任,主任醫師,教授,上海醫學會腎臟病學會委員和青年委員、國際腎臟病學會員、全國人工肝學組委員、上海市醫苑新星、...
段鐘平,男。主任醫師,教授,博士生導師。1998年獲首都醫科大學內科學博士學位,之後在首都醫科大學附屬北京佑安醫院工作至今。兼任中華醫學會肝病學分會主任委員兼重肝...
葉衛江,主任醫師,杭州市第六人民醫院重症肝病科兼人工肝治療中心主任,杭州市重型肝炎治療重點專病學科帶頭人,浙江省感染性疾病重點學科後備學科帶頭人,中華醫學會肝病...
專業特長: 肝硬化食管靜脈曲張內鏡下套扎治療(EVL);頑固性腹水和肝功能衰竭的人工肝支持治療;重症急性胰腺炎的救治;食管賁門狹窄的內鏡下球囊擴張治療;消化道出血的...
主要從事胰島移植治療糖尿病,幹細胞技術治療糖尿病和生物人工肝等方面的研究。主持國家自然科學基金重點課題,國家“973”計畫和國家“863”計畫等研究課題。獲得國家...
3、生物人工肝細胞反應器規模化生產及儲存方案的構建與最佳化, 2007年-2010年, 廣東省教育部產學研結合項目,40萬 目前可支配總經費:1251萬。...
教授主任醫師現任中華醫學會腎臟病學分會血液淨化學組成員、中國醫院管理學會血液淨化中心管理分會委員;全國人工肝血液淨化攻關協作組委員;江蘇省醫學會第九屆理事會...
