在稀溶液中酸鹼中和生成1mol水的反應熱。
一元強酸與強鹼的中和熱約為-57kJ,與酸鹼種類無關,因為這實際上是1molH+與1molOH-反應生成1molH2O的反應熱。
弱酸、弱鹼以及多元酸鹼的中和熱,因有電離熱的影響,不是定值。
基本介紹
- 中文名:中和熱
- 外文名:neutralization heat
- 術語類型:化學反應術語
- 發生條件:酸鹼發生反應
定義,要點,注意點,實例,測定,步驟,起始溫度,注意事項,
定義
在稀溶液中,強酸跟強鹼發生中和反應生成1 mol液態水時所釋放的熱量叫做中和熱.
要點
1.必須是酸和鹼的稀溶液,因為濃酸溶液和濃鹼溶液在相互稀釋時會放熱.
2.強酸和強鹼的稀溶液反應才能保證H+(aq)+OH-(aq)=H2O(l)中和熱均為57.3 kJ·mol-1,而弱酸或弱鹼在中和反應中由於電離吸收熱量,其中和熱小於57.3 kJ·mol-1;
3.以生成1 mol水為基準。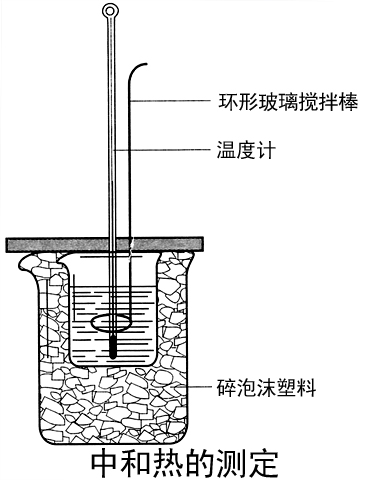 中和熱
中和熱
 中和熱
中和熱4.反應不可以生成沉澱(如Ba(OH)2+H2SO4=BaSO4+2H2O)
注意點
中和熱是以生成1 mol H2O所放出的熱量來測定的,因此書寫它們的熱化學方程式時,應以生成1 mol水為標準來配平其餘物質的化學計量數。
實例
發生中和反應時,由於所用的酸和鹼有強弱不同,又有一元、二元或多元之分,因而中和熱各不相同。
- 一元弱酸跟一元強鹼的中和熱
如果有一元弱酸或弱鹼參加中和反應,其中和熱所放出熱量一般都低於57.3 kJ/mol,也有個別高於57.3 kJ/mol的。這主要取決於弱酸或弱鹼電離時吸熱還是放熱。
一般地說,弱酸或弱鹼的電離是吸熱的,因此,中和反應所放出的熱量還要扣除電離時吸收的那部分熱量,中和熱也就低於57.3 kJ/mol。例如,1 mol CH3COOH跟1 mol NaOH溶液反應時,中和熱是56.0 kJ/mol。
有的弱電解質電離時是放熱的。例如,1 mol氫氟酸電離時放出10.4 kJ/mol熱量。當它跟1 mol NaOH溶液反應時,中和熱是67.7 kJ/mol。
- 二元酸跟一元強鹼的中和熱
二元酸的電離是分兩步進行的,兩個H+的中和熱各不相同。中和第一個H+的中和熱,等於57.3 kJ/mol減去二元酸電離出第一個H+所吸收的熱量ΔH1;中和第二個H+的中和熱,等於57.3 kJ/mol減去二元酸電離出第二個H+所吸收的熱量ΔH2。因此,二元酸跟一元強鹼的中和熱ΔH可用下式表示: 中和熱
中和熱
 中和熱
中和熱ΔH=-〔2×57.3 kJ/mol-(ΔH1+ΔH2)〕
- 多元酸跟一元強鹼的中和熱
三元酸跟一元強鹼的中和熱為ΔH,三元酸里的三個H+電離時所吸收的熱量依次是ΔH1、ΔH2、ΔH3,則得:ΔH=-〔3×57.3 kJ/mol-(ΔH1+ΔH2+ΔH3)〕
測定
步驟
- 在大燒杯底部墊泡沫塑膠(或碎紙屑),使放入的小燒杯杯口與大燒杯杯口相平。然後再在大、小燒杯之間填滿碎泡沫塑膠(或紙條),大燒杯上用泡沫塑膠板(或硬紙板)作蓋板,在板中間開兩個小孔,正好使溫度計和環形玻璃攪拌棒通過,如下圖所示。
- 2.用一個量筒量取50 mL 0.50 mol/L鹽酸,倒入小燒杯中,並用溫度計測量鹽酸的溫度,記入下表。然後把溫度計上的酸用水沖洗乾淨。
- 用另一個量筒量取50 mL 0.55 mol/L NaOH溶液,並用溫度計測量NaOH溶液的溫度,記入下表。
- 把溫度計和環形玻璃攪拌棒放入小燒杯的鹽酸中,並把量筒中的NaOH溶液一次倒入小燒杯(注意不要灑到外面)。用環形玻璃攪拌棒輕輕攪動溶液,並準確讀取混合溶液的最高溫度,記為終止溫度,記入下表。
- 重複實驗兩次,取測量所得數據的平均值作為計算依據。
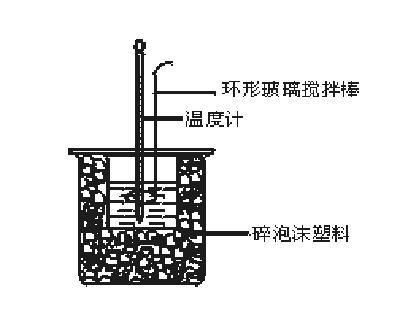 實驗裝置
實驗裝置起始溫度
關於量HCl和NaOH溶液的起始溫度“t1/℃”
①不能以空氣的溫度去代替酸鹼溶液的溫度;也不能以水的溫度去代替酸鹼溶液的溫度,因為空氣、水和溶液(這裡是酸鹼)的溫度是有差別的,會明顯影響實驗結果。
②為了使NaOH和HCl溶液的溫度穩定,最好是把配成的溶液過夜後使用。
③最好不求HCl和NaOH兩種溶液溫度的平均值。兩者的溫度懸殊差別越大,實驗結果越是失去意義,最好是兩種溶液的溫度相同。辦法是:用手握住燒杯使溫度低的溶液略有升高,或用自來水使溫度高的溶液略微降溫,以達到兩種溶液溫度相同的目的。 中和熱
中和熱
 中和熱
中和熱讀者注意,中和熱的測定最好在20℃左右的環境溫度條件下進行,不宜低於10℃以下,否則低溫環境容易散熱,會使中和熱的測定值明顯偏低。
④為什麼採用環形玻璃棒攪拌混合液,可不可以用普通玻璃棒?能不能用振盪的方法混勻溶液?
環形玻璃棒的優點在於:上下移動攪拌的面積大、範圍廣(切不可把環形玻璃棒移出混合液的液面!),混合均勻,普通玻璃棒顯然不具有這種優點。
至於振盪混合液,一定會有部分混合液附著在燒杯壁,這樣散失的熱量會使中和熱的測定值偏低。
⑤強酸與弱鹼,強鹼與弱酸的中和反應熱值如何估計?
鑒於弱酸、弱鹼在水溶液中只能部分電離,因此,當強酸與弱鹼、強鹼與弱酸發生中和反應時同時還有弱鹼和弱酸的不斷電離(吸收熱量,即電離熱)。
所以,總的熱效應比強酸強鹼中和時的熱效應值(57.3KJ/mol)要小一些。
值得注意的是,有少數弱電解質(如氫氟酸)電離時會放熱,它與NaOH的中和熱會大於57.3KJ/mol(實為67.7KJ/mol)。
⑥酸鹼的濃度該有個什麼大小範圍?太大、太小對測定值會有什麼影響?
如果強酸強鹼溶液的濃度太大,混合時由於體積增大,離子繼續擴散水合產生熱效應。離子的水合熱大於擴散熱,使總過程放熱,使得測得的熱值偏高。但是酸鹼溶液的濃度也不可太小,否則中和反應放出的熱太少,溫度變化不大,不易測出。經驗指出,測定中和熱的酸鹼的濃度大小範圍以在0.10mol·L~1.0mol·L之間為宜。
⑦本測定有許多難以克服的概略因素:反應容器(燒杯、環形玻璃棒攪拌器)要吸收一些熱量,反應混合液的空間要散失一些熱量,以及量取溶液體積、溫度計讀數以及溫度計的精確度等都會產生一些誤差,所以本測定只能是近似測定強酸強鹼的中和熱值。
注意事項
選擇合適濃度的酸溶液和鹼溶液進行反應,一般使一種反應物稍過量,通常用0 . 5 0mo l /L的HCl 溶液和0.55mol/L的NaOH溶液,等體積混合,使酸完全反應。選擇合適的酸和鹼,考慮到濃硫酸遇水放熱,而弱酸、弱鹼電離時要吸熱,以防止其他因素的影響,常以0.50mol/L的HCl溶液和0.55mol/L的NaOH溶液進行實驗。
測定要準確,記錄溫度要及時,中和熱是通過測定溫度的變化來計算的,要知道每一階段溶液的準確溫度,需做好溫度數據的記錄。
注意儀器使用,在測定鹽酸溶液的溫度後,要用水洗淨溫度計上的少量酸液,帶入到鹼溶液中會由於反應放熱而影響到鹼溶液溫度的變化,還應選用兩支不同的吸量管分別量取鹽酸與氫氧化鈉溶液。
注意保溫,溫度的變化對實驗結果會造成較大的誤差,測量必須在相對隔熱的裝置中進行,保證裝置的隔熱效果,在測量溫度時,應該選取混合液的最高溫度作為測定值。

