Saegusa–Ito氧化反應,也可稱三枝–伊藤氧化反應。它是有機化學中一個將碳-碳單鍵轉變為碳-碳雙鍵的反應。這個在羰基化合物中引入α,β-不飽和結構的方法是由京都大學的三枝武夫和伊藤嘉彥在1978年發現的。最初報導的方法是先將酮轉化為相應的烯醇矽醚,接著將烯醇矽醚與醋酸鈀和對苯醌反應從而產生α,β-不飽和羰基化合物。最早的原始文獻指出可利用產物中新形成的不飽和雙鍵,通過親核試劑(比如有機銅試劑)對其進行1,4-加成反應以達到進一步衍生化的目的。
對於非環狀底物,反應只會得到熱力學產物反式烯酮。
實際上在三枝武夫和伊藤嘉彥發表這一發現的八年之前,就已有一篇文獻報導稱可用未活化的酮和醋酸鈀反應亦能得到相同的產物,但產率較低。三枝和伊藤為此對這一反應所做的重大改進就是明確了烯醇式是反應的活性物種,並由此開發出了這種基於烯醇矽醚的方法。通過先將醛或酮用強鹼性的2,2,6,6-四甲基哌啶鋰或二異丙基氨基鋰處理,發生去質子化生成烯醇負離子中間體,後加入三甲基氯矽烷捕獲負離子中間體的方法可以方便地合成Saegusa氧化所用的原料烯醇矽醚。由於這個烯醇矽醚合成方法的副產物僅為氯化鋰和胺,它們對後續的氧化反應沒有較大影響並且烯醇矽醚容易水解,所以用這個方法合成出的烯醇矽醚可不經分離純化直接用於接下來的Saegusa氧化反應。
基本介紹
- 中文名:Saegusa-Ito氧化反應
- 外文名:Ito Saegusa - oxidation reaction
- 可稱:三枝–伊藤氧化反應
- 機理:反應通常採用近當量的鈀
反應機理,套用,反應的變體,注釋,
反應機理
反應通常採用近當量的鈀,如果故一般對於工業生產來說成本過高,不過人們已在催化劑變體的開發上已經取得了一些進展。雖然該方法存在缺點,但三枝氧化反應依然是一個溫和的合成方法,可用於在合成路線的尾端向具有多種官能團的複雜分子中引入新的官能團。
三枝–伊藤氧化反應的機理如下:首先是二價鈀與烯醇矽醚雙鍵的配位,隨後三甲基矽基與醋酸根形成三甲基矽基醋酸酯離去,同時形成烯醇鈀物種,接著發生β-氫消除得到鈀氫物種的烯酮絡合物,最後鈀氫物種發生還原消除得到產物同時生成醋酸和零價鈀。β-氫消除步驟是一個存在化學平衡的可逆反應,所以對於非環狀的底物,反應會選擇性地生成反式雙鍵構型的熱力學產物。有證據顯示零價鈀會與反應產物形成類似Pd2(dba)3的配合物,使得零價鈀很難被氧化再生。
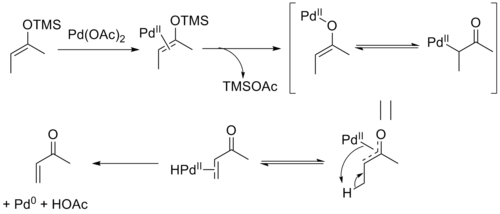
以對苯醌為氧化劑可將零價的鈀氧化使二價鈀再生:
也能以氧氣為氧化劑使二價鈀再生:
- (重新進入循環)
套用
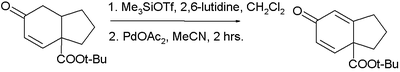
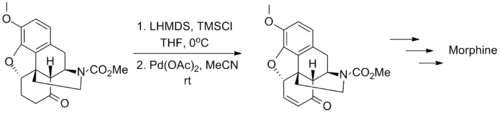
Saegusa-Ito氧化反應具有廣泛適用性,使得它可用於多個天然化合物分子的全合成中,下面的幾個例子就能很好的體現出這一特點。
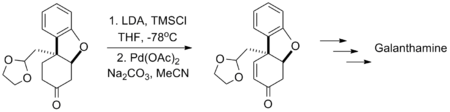
Larry E. Overman利用“一鍋法”連續進行了兩步氧化反套用以合成天然產物Laurenyne,先將含有羥基的底物分子用氯鉻酸吡啶鹽將醇氧化成醛,緊接著利用三枝–伊藤氧化將中間體醛氧化成α,β-不飽和醛,底物分子中的氯代烷和磺酸酯結構均不受反應的影響。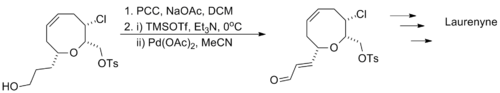
David Williams設計了一種新的Saegusa-Ito氧化反應通過對底物分子中未保護的烯醇部分進行氧化來合成Sambutoxin。先是發生烯醇的氧化得到中間體烯酮,隨後烯酮的部分受到分子內親核試劑羥基的進攻,原位重新生成烯醇同時形成一個五元環的四氫呋喃結構。最後通過甲氧基甲基的脫保護完成這個天然產物的合成。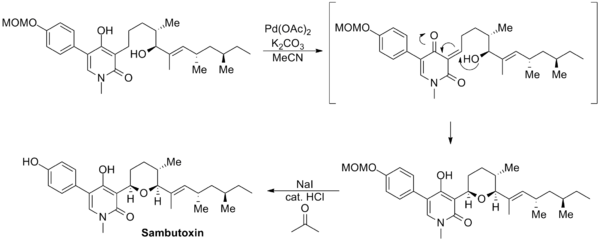

反應的變體
該氧化反應最大的一個缺點就是需要耗費化學當量的醋酸鈀,即使是原始文獻中所報導的方法,通過加入氧化劑對苯醌從而能相對減少醋酸鈀的用量,但即使這樣也需要加入0.5當量的醋酸鈀,而理論上講是能將反應所需的醋酸鈀減至催化量的。有效地將反應生成的零價鈀氧化再生是將醋酸鈀用量減至催化量的關鍵。所以Larock(Richard C. Larock)對這個反應條件做了改進,在以DMSO溶劑的氧氣氛圍中使零價鈀氧化再生,使得反應所需的醋酸鈀用量降至催化量。

但是拉洛克改進後的反應條件會大大延長反應的時間同時產物收率也會顯著降低,西田篤(Atsushi Nishida)等人在用三枝–伊藤氧化反應合成Platyphyllide時就採取和拉洛克截然相反的策略,即不額外加入氧化劑而是使用等當量的醋酸鈀,則反應僅需較短的時間就能完成且產物有較高的收率,這兩種方法的反差就凸顯了使用催化量醋酸鈀方法的缺點。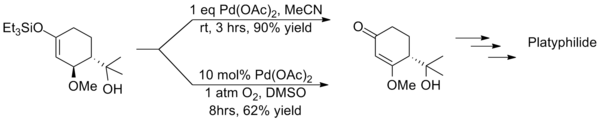
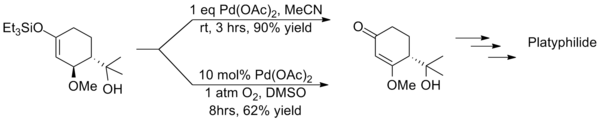
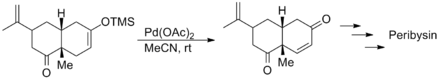
佐佐木誠等人在合成(−)-Gambierol的過程中也使用三枝–伊藤氧化反應來構築(-)-Gambierol分子中的一個三並環的片段,他們採取和西田篤相同的策略,因為反應的規模很小,為追求較高的產率和較快的轉化速率而使用了大大過量的醋酸鈀,使氧化反應在不到一個小時的時間內就完成了。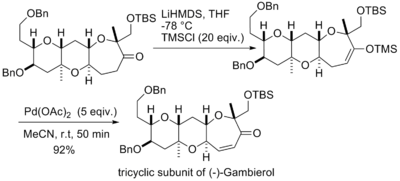

井原正隆等人利用經拉洛克改進後的反應條件合成了天然化合物(±)-8,14-雪松二醇和(±)-8,14-環氧柏木烷。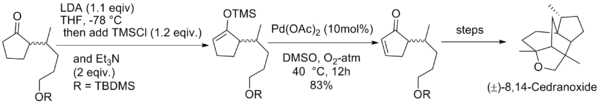
利用零價鈀的配合物能對烯丙基碳酸酯發生氧化加成二價的烯丙基鈀絡合物的性質,辻二郎發展了一種以碳酸二烯丙基酯為氧化劑的三枝–伊藤氧化反應,也是只需使用催化量的醋酸鈀並加入相同催化量的雙膦配體dppe就能高效地實現該反應,選擇適當的溶劑是實現該方法的關鍵:只有使用乙腈作為溶劑才能生成烯酮,而使用乙醚作溶劑則會發生烯丙基取代反應生成α-烯丙基羰基化合物。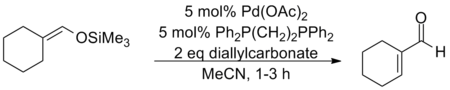
辻二郎改進後的Saegusa-Ito氧化反應作為一種合成工具在天然化合物的全合成中已經取得了成功,柴崎正勝利用這個方法成功地合成了馬錢子鹼。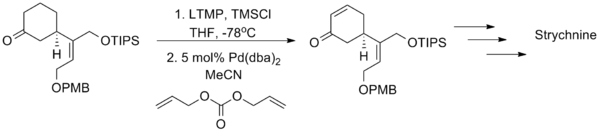

注釋
- MOM:甲氧基甲基
- rt表示為“室溫”
- TBDMS:叔丁基二甲基矽基;(±)-8,14-Cedranoxide:(±)-8,14-環氧柏木烷
- diallycarbonate:碳酸二烯丙基酯