藥物介紹,歷程,第一次申請,申請被拒,第二次申請,最新研究,
藥物介紹
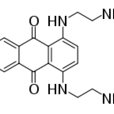
pixantrone(6,9 - 二[(2 - 氨乙基)氨基]苯並[g]喹啉-5,10-二酮)是目前在研中的抗腫瘤藥,其與蒽醌相似但對心肌組織毒副作用更小。對拓撲異構酶II有毒性作用的螯合劑。目前出於FDA上市申請審批中。
歷程
第一次申請
2009年,FDA接受復發性、侵襲性非何杰金淋巴瘤(NHL)治療藥物pixantrone的上市申請。本品是一種新穎的蒽類化合物,I/II期臨床研究顯示,pixantrone單一用藥的疾病完全緩解率達到20%,當pixantrone替換了標準治療藥物CHOP(環磷醯胺+多柔比星+長春新鹼+潑尼松,cyclophosphamide+doxorubicin+vincristine+prednisone)中的多柔比星時,疾病的完全緩解率達到59%.III期臨床也獲得了肯定結果。
申請被拒
美國食品藥品管理局(FDA) 腫瘤藥物顧問委員會以9-0的投票結果駁回了pixantrone maleate的上市批准,因該藥III期研究的數據不夠充分。因此,針對難治性非霍奇金淋巴瘤的單藥三線治療藥物尚需時日才能上市。
該顧問委員會在3月22日表示,該試驗(由於招募數量不足50%而終止)數據缺乏支持批准該藥的必要穩健性。專家組還擔心,該試驗結果可能不能外推至美國患者,因為最終分析所納入的140例患者中僅有8例來自美國國內的研究中心。
該藥的套用基於一項III期試驗的結果。在該試驗中,患者在第一周隨機接受pixantrone 85 mg/m2或對照藥物治療(醫生自行選擇長春瑞濱、奧沙利鉑、異環磷醯胺、米托蒽醌、依託泊苷、吉西他濱或利妥昔單抗進行治療),每3周為一個周期,共6個周期。
患者須患有3級濾泡性淋巴瘤、轉化淋巴瘤、瀰漫性大B細胞淋巴瘤、外周T細胞淋巴瘤或間變性大細胞淋巴瘤。他們此前還須曾接受至少兩種聯合化療方案治療;一線方案必須包含一種蒽環類或蒽醌類藥物。總阿黴素等效劑量必須低於450 mg/m2,射血分數至少為50%。 患者必須對其此前服用的蒽環類或蒽醌類藥物敏感。
由1名放射醫生、1名腫瘤醫生和1名病理醫生組成獨立評價小組,對治療有效與否進行判定。該小組對一項獨立的盲法放射學綜述及臨床和實驗室資料進行了評價。在初步分析中,對意向治療人群完全緩解率與未經證實完全緩解率的差異(CR/CRu)進行了評價。
FDA表示,該試驗的CR/CRu率不可靠,原因包括:患者數量少,對低有效率進行再次分析和升級,缺乏放射學判定以及在對pixantrone組CR/CRu率進行集中分析時納入了數例組織學證據不合格的患者。
第二次申請
細胞治療公司(CellTherapeutics)近日宣布,美國食品和藥品管理局(FDA)的新藥辦公室(OND)稱,基於單個對照的臨床試驗結果,如果下述兩個關鍵問題能夠得到滿意解決,那么Pixantrone新藥申請(NDA)022481號的加速審批是完全可能的。該藥設計用於治療復發性難治性侵襲性NHL。
最新研究
2011年4月刊的同行評論期刊《Leukemia & LymPHoma》(白血病和淋巴瘤)公布了評價環磷醯胺、pixantrone、長春新鹼和潑尼松(CPOP)治療進展性非霍奇金淋巴瘤(NHL)患者療效的1 / 2期臨床試驗結果,這些患者用環磷醯胺、阿黴素、長春新鹼(Oncovin)和潑尼松(CHOP)初始治療後復發。在CPOP方案中,pixantrone 替代了CHOP方案中的多柔比星(H)。德國科隆大學醫院的Peter Borchmann醫學博士領導了這項研究。CPOP產生了比較高的完全緩解率(CR)和總體有效率(ORR)。對於某些患者,儘管其在接受CHOP及其他多藥聯合治療後復發,這些緩解仍具有高度的持久性。
美國食品與藥物管理局(FDA)計畫在2 月 9 日對 pixantrone 進行評審,但其生產 商撤銷了申請,並表示將在今年稍後時間 再次遞交申請。