MAPK信號通路成員,MKKK,MKK,MAPK,發現,類型,MAPK結構,一級結構,二級和超二級結構,空間結構,MAPK的激活,失活,信號級聯,MAPK通路,MAPK通路模式與功能,
MAPK信號通路成員 MAPK是信號從細胞表面傳導到細胞核內部的重要傳遞者。已在哺乳動物細胞中鑑定了14種MKKK,7種MKK和12種MAPK。分析顯示,這些激酶屬於不同亞族。
MKKK MKKK的4個亞族已得到鑑定,其中Raf亞族研究的最為透徹,包括B-Raf、A-Raf、Raf1。MEKK亞族由4種MEKK(MEKK1~MEKK4)構成。ASK1和Tpl2組成了MKKK的第三個亞族。第四個亞族與上述三個有較大不同,它包括MST(mammalian sterile 20-like)、SPRK、MUK(MAPK upstream kinase)、TAK1,以及相關程度最小的MOS(molony sarcoma oncoprotein)。
MKK 對於MKK來說,MEK1與MEK2密切相關,而MKK3則與MKK6密切相關。
MAPK MAPK可分為4個亞族:ERK、p38、JNK和ERK5。這些通路由它們而得名,例如利用JNK的MAPK通路被稱為JNK通路。
發現 在哺乳動物中發現的第一個絲裂原活化蛋白激酶是ERK1(MAPK3)。由於ERK1及其近親ERK2(MAPK1)均參與生長因子信號傳導,因此該家族被冠名“絲裂原激活”。隨著其他MAPK成員的發現,越來越明確這個名字是一個誤稱,因為大多數MAPK實際上參與對潛在有害的非生物應激刺激(高滲透壓、氧化應激、DNA損傷、低滲透壓)的反應。哺乳動物ERK1/2激酶作為細胞增殖調節劑的作用不是一般的,而是高度特化的功能。
類型 大多數MAPK具有許多共同的特徵,例如依賴於兩個磷酸化事件的激活、三層通路結構和類似的底物識別位點。這些是“經典”的MAPK。但是,也有一些古老的“離群”激酶,它們不具有雙重磷酸化位點,僅形成兩層通路,並且缺乏其他MAPK所需的底物結合特徵。這些通常被稱為“非典型”MAPKs。還不清楚這些非典型MAPKs是否形成與經典MAPKs相反的獨立群體。
MAPK結構 一級結構 MKK都是通過雙位點,即蘇氨酸(T)和酪氨酸(Y)同時磷酸化激活MAPK。這兩個磷酸化位點中間被一胺基酸隔開,構成三肽基TXY。不同的MAPK亞族成員,其雙磷酸化位點之間的X殘基不同,但是其各個亞族都具有標準的12個保守亞區,這些亞區是區分真核細胞蛋白激酶超家族的標誌之一。MAPK家族成員之間具有較高的同源性。例如,p38β、p38γ和p38δ分別與p38α具有75%、62%和64%的同源性,而與其他MAPK家族成員的同源性約為40%~50%。三肽基位於蛋白激酶地VII和VIII亞區之間的Loop12環狀結構內,該環位於分子表面並臨近活性位點,其中部分殘基形成一種唇狀結構,被稱為磷酸化唇或活化唇(activation lip)。這一區域被認為是決定包括MAPK在內的多種蛋白激酶活性的關鍵結構。
MAPK雙磷酸化 二級和超二級結構 與其他蛋白激酶相似,ERK2、p38和JNK1都具有一個較小的胺基酸結構域和一個較大的羧基端結構域,兩者之間由一個交叉區連線在一起。胺基酸結構域主要由β摺疊組成,而羧基端結構域則主要為α螺旋,兩個結構與交界處形成一個裂隙,為
ATP 結合位點。
ATP結合位點示意圖 空間結構 大體結構:
p38與ERK2具有約40%序列同源性。將p38和ERK2的兩個結構域同時重疊在一起時,其根均平方(root mean square ,RMS)偏離為0.17nm。JNK與ERK2和p38的同源性分別為40%和51%,其總體結構也與ERK2和p38非常相似。將ERK2和p38的羧基端結構域與JNK的羧基端結構域重疊式,兩者較JNK3的羧基端結構域分別旋轉了2.5°和4°。將ERK2的胺基酸和羧基端結構域與JNK3的對應結構域重疊時,其RMS偏離分別為0.115nm和0.158nm。
底物結合口袋的結構特徵:
在所有MAPK中,形成底物結合口袋的胺基酸殘基都是相當保守的。在未受到刺激時,ERK2的底物結合口袋被Arg192 占據;當ERK2被磷酸化後,Arg192 轉離原來的位置,從而暴露出底物結合口袋來進行底物的結合。p38中,該位點活化機制尚不清楚。
MAPK的激活 Superposition of ERK2 (green and gold) MAPK的活性被認為是由活化環的胺基酸序列中的雙磷酸化位點所調控。MAPK活化環中的TXY序列是特定的MKK催化進行雙磷酸化反應的位點。對於ERK/ERK2來說,雙磷酸化位點是Thr183 和Tyr185 。這些位點的雙磷酸化使MAPK的活性增加一千倍以上。
MAPK在它們的鹼形式中是沒有催化活性的。為了變得活躍,它們需要它們的活化環中發生(可能多個)磷酸化事件。這是由STE蛋白激酶組的專門酶進行的。
在經典MAP激酶的情況下,活化環包含一個特徵性的TxY (蘇氨酸-x-酪氨酸) motif (哺乳動物ERK1和ERK2中的TEY,ERK5中的TDY,JNK中的TPY,p38激酶中的TGY),為了把激酶結構域鎖定在一個有催化活性的構象上,需要在蘇氨酸和酪氨酸兩個殘基上都進行磷酸化。在體內和體外,酪氨酸的磷酸化常常先於蘇氨酸的磷酸化,儘管任一殘基的磷酸化都可以在沒有另一殘基的情況下發生。
這個串聯活化環的磷酸化由Ste7蛋白激酶家族的成員,也就是MAP2激酶來執行。MAP2激酶又由許多不同的上遊絲氨酸蘇氨酸激酶(MAP3激酶)磷酸化激活。由於MAP2激酶在其同源MAPK以外的底物上顯示非常小的活性,經典MAPK通路形成多層次,但相對線性的信號通路。這些信號通路可以有效地將刺激從細胞膜(在這裡許多MAP3K被激活)傳遞到細胞核(只有MAPK可以進入核內)或許多其他的亞細胞靶點。
與三層的經典MAPK通路相比,一些非典型MAP激酶似乎具有更古老的兩層系統。ERK3(MAPK6)和ERK4(MAPK4)最近被證明是被直接磷酸化的,因此被PAK激酶(與其他MAP3激酶相關)激活。與經典的MAP激酶相比,這些非典型MAPK只需要在它們的活化環中有一個殘基被磷酸化。NLK和Erk7(MAPK15)激活的細節尚不清楚。
失活 MAPKs的失活是由各種磷酸酶執行的。一個非常保守的專門磷酸酶家族是所謂的MAP激酶磷酸酶(MKP),它是雙特異性磷酸酶(DUSP)的一個亞群。[5]顧名思義,這些酶能夠從磷酸酪氨酸和磷酸蘇氨酸殘基中水解磷酸基團。由於去除任一磷酸基團將大大降低MAPK活性,基本上消除信號,因此一些酪氨酸磷酸酶也參與滅活MAP激酶(例如,哺乳動物中的磷酸酶HePTP、STEP和PTRR)。
信號級聯 如上所述,MAPK通常形成多層通路,接收比實際MAP激酶高几層的輸入。與MAPKs和MAP2Ks相對簡單、磷酸化依賴的激活機制相比,MAP3Ks具有驚人的複雜調控。許多了解得更多的MAP3K,如c-Raf、MEKK4或MLK3,需要多個步驟來激活它們。這些酶通常是受變構效應控制的酶,通過多種機制緊密地鎖定在非活性狀態。激活它們的第一步是通過較小的配體(如c-Raf的Ras、MEKKK4的GADD45或MLK3的Cdc42)來減輕它們的自抑制。這通常發生在細胞膜上(但不總是),它們的大多數激活劑是結合在細胞膜上的(注意,由於異戊烯化修飾,小G蛋白是一直聯繫在細胞膜上的)。此步驟之後是“背靠背”的對它們現在可訪問的激酶結構域的同源和異源二聚化。最近確定的複合物結構顯示二聚體的形成方向使它們的兩個底物結合區都自由。重要的是,這種二聚化事件還迫使MAP3激酶結構域採用部分活性構象。只有當這些二聚體在它們的活化環上相互磷酸化時,才能達到完全活性。後一步驟也可以通過輔助蛋白激酶(MAP4激酶,Ste20家族的成員)實現或輔助。一旦MAP3激酶完全激活,它可以磷酸化其底物MAP2激酶,這反過來又讓MAP2激酶磷酸化它們的MAP激酶底物。
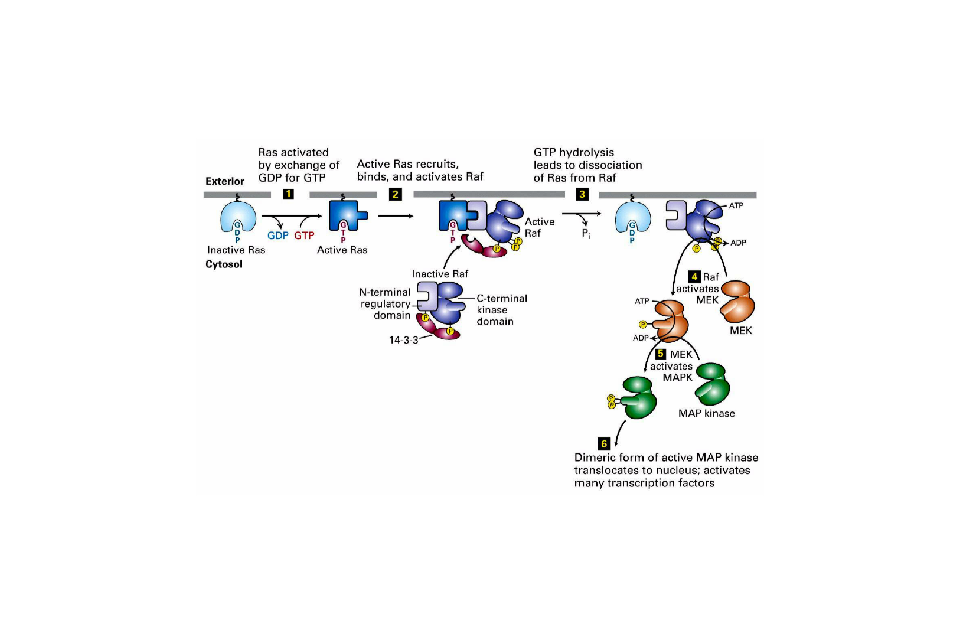
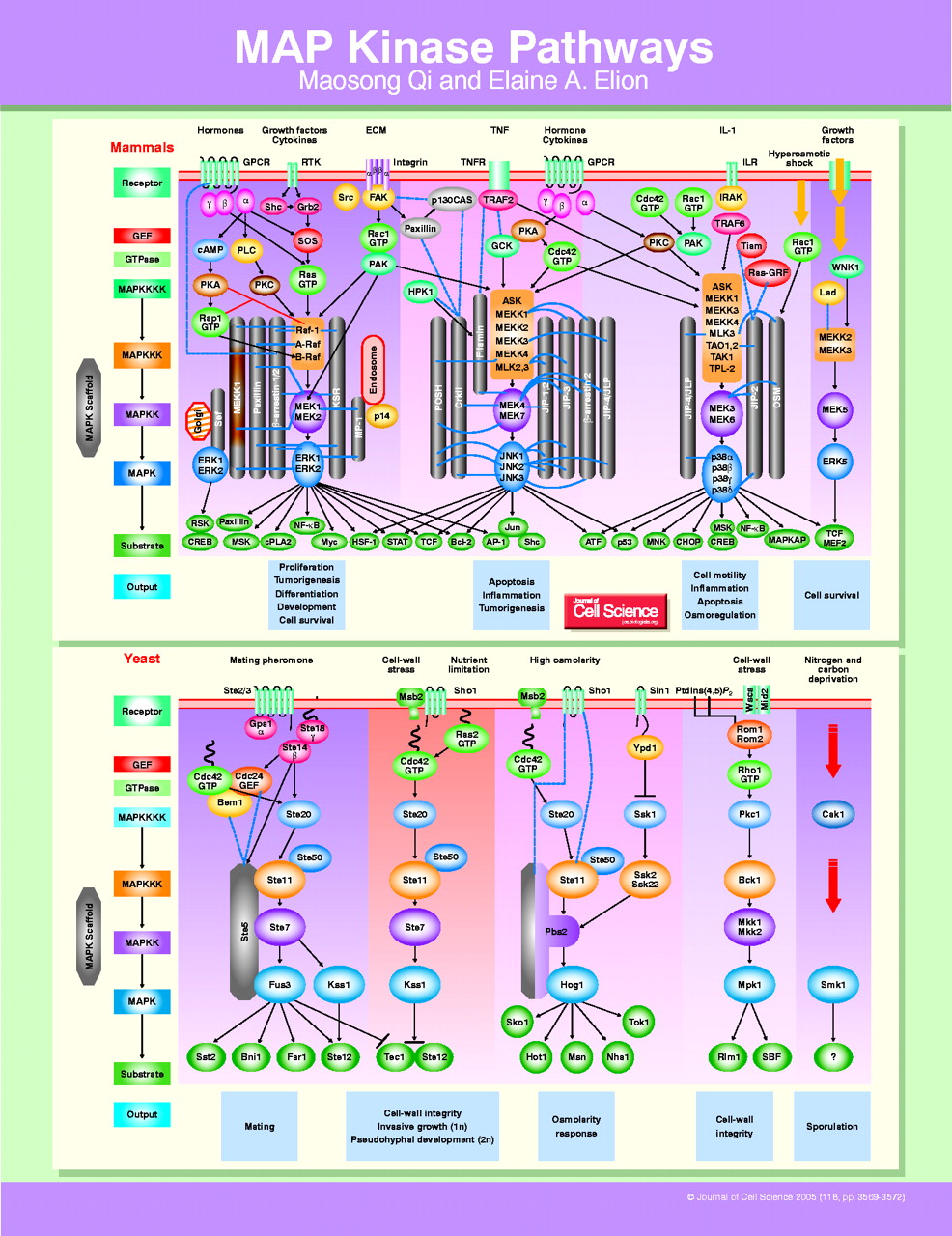
MAPK通路 MAPK通路是細胞增殖、應激、炎症、分化、功能同步化、轉化、凋亡等信號轉導通路的共同交匯通路之一,把胞外信號經受體、G蛋白/小G、蛋白激酶、轉錄因子等組成的信號網路,傳遞到胞內,參與細胞增殖、分化、癌變、轉移、凋亡等,不同的生長刺激、應激刺激,在不同的細胞.經不同細胞骨架局限的不同信號通路,可產生多種效應。MAPK的激活是細胞內磷酸化級聯反應的最終步驟,經典的MAPK級聯反應包括MAPKKKK(如Ras、Rho)一MAPKK激酶(MAPKKK)一將MAPKK絲氨酸/蘇氨酸磷酸化一激活的MAPKK將MAPK的蘇氨酸/酪氨酸雙重磷酸化,激活MAPK。MAPK信號轉導通路中存在的增強因子,可與MAPKKKs、MAPKKs和MAPKs結合,增碣卜游漸酶對官們的漸活能力。
MAPK通路模式與功能 很多刺激,如生長因子、細胞因子、射線、滲透壓以及體液流過細胞表面時產生的切應力等因素都可以激活MAPK
信號轉導 通路。模式圖如右圖所示。
MAPK級聯激活是多種信號通路的中心,是接收膜受體轉換與傳遞的信號並將其帶入細胞核內的一類重要分子,在許多細胞增殖相關信號通路中具有關鍵作用。在未受刺激的細胞內,MAPK處於靜止狀態。細胞受到生長因子或其他因素刺激後,MAPK接收MKK和MKKK的活化信號而被激活,表現為逐級磷酸化。哺乳動物中,ERK廣泛存在於各種組織,參與細胞的增殖分化的調控。多種生長因子受體、營養相關因子受體等都需要ERK的活化來完成信號轉導過程。JNK家族是細胞對各種應激原誘導的信號轉導的關鍵分子,參與細胞對輻射、滲透壓、溫度變化等
應激反應 。p38介導炎症、凋亡等,因而成為開發抗炎藥物的靶位。
MAPK通路
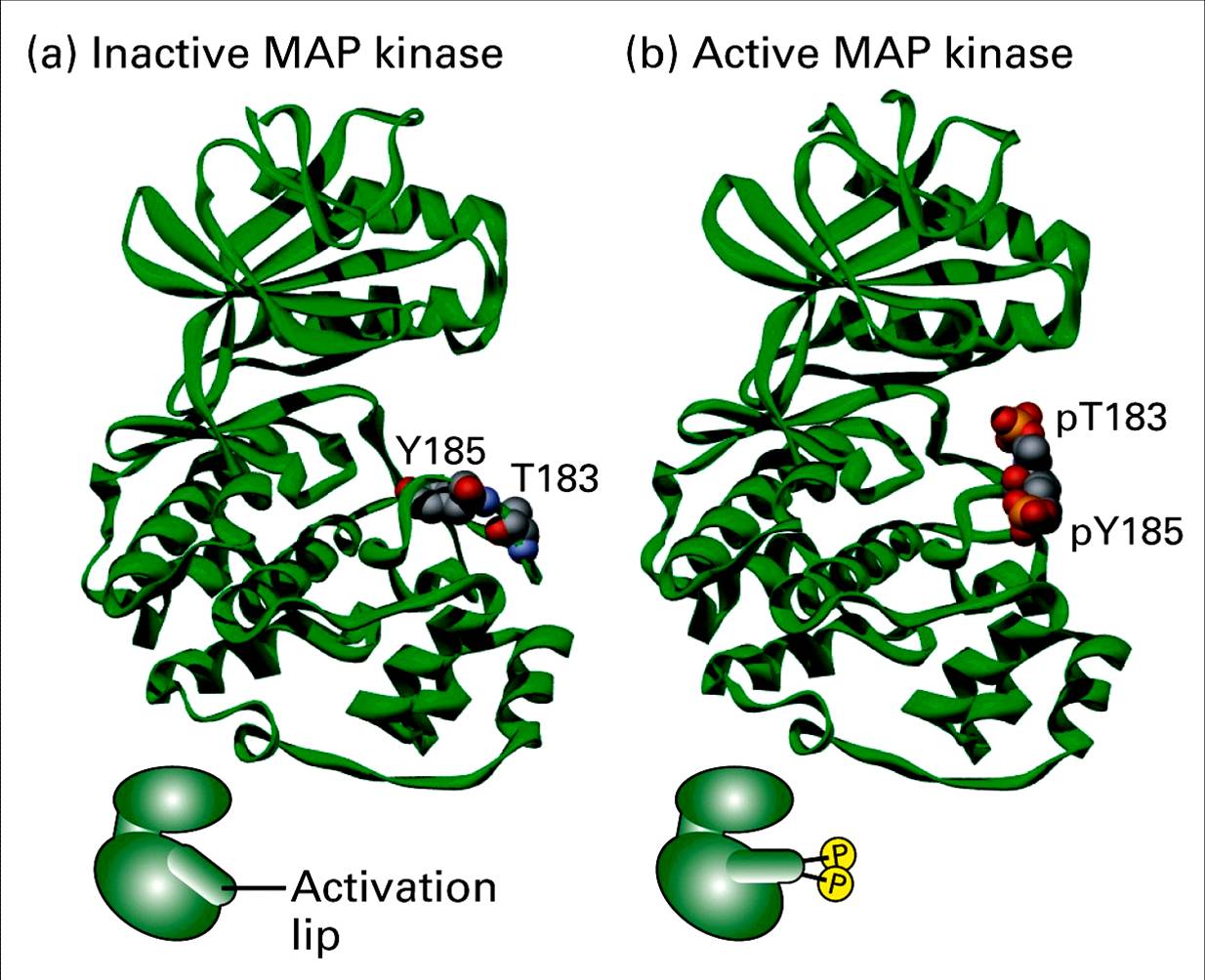 MAPK雙磷酸化
MAPK雙磷酸化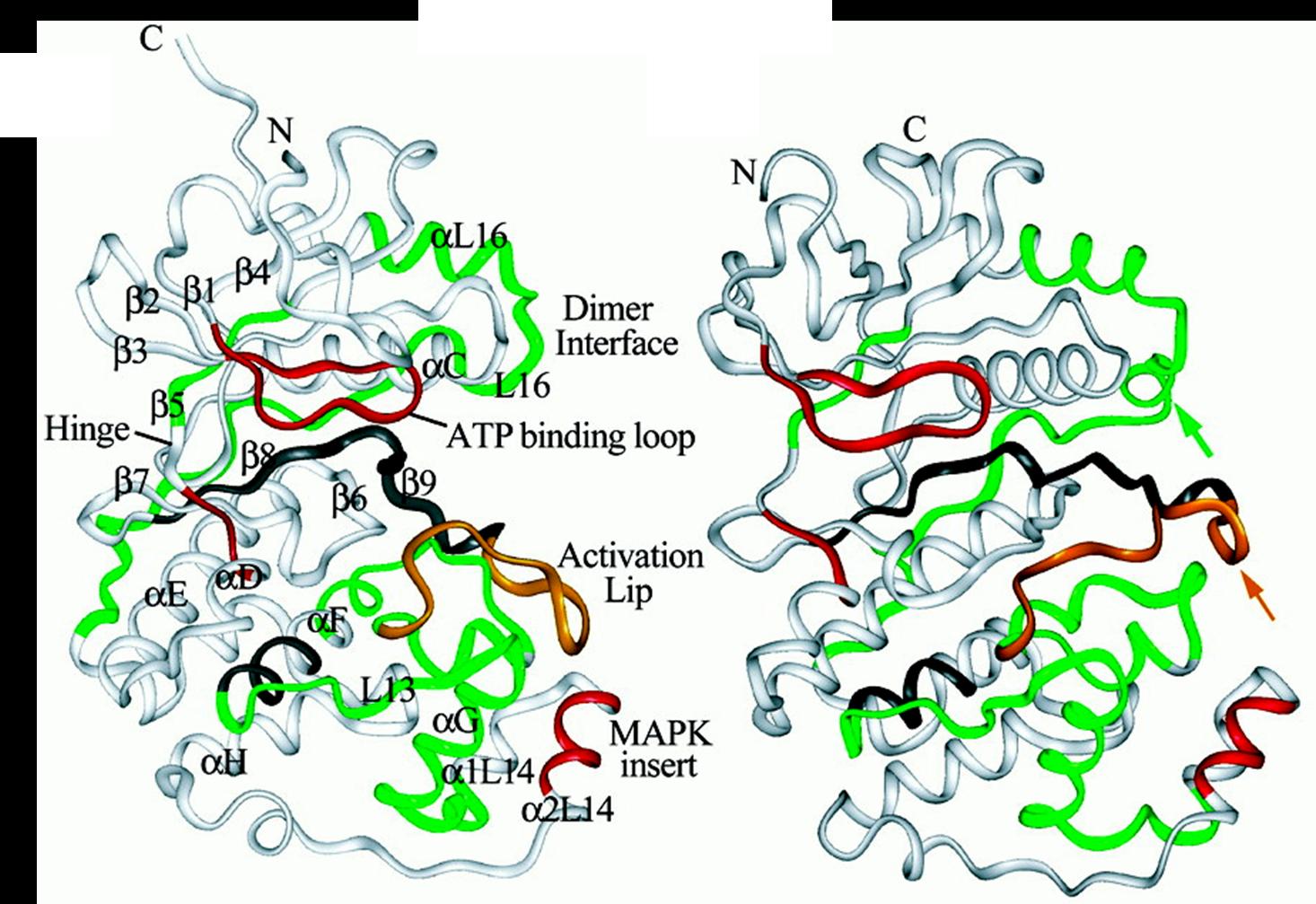 ATP結合位點示意圖
ATP結合位點示意圖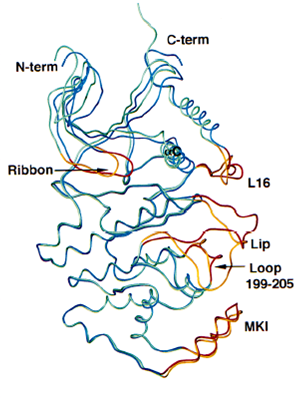 Superposition of ERK2 (green and gold)
Superposition of ERK2 (green and gold)
 MAPK通路
MAPK通路