臨床數據交換標準協會(CDISC)是一個開放的、包括各種學科的非盈利性機構。協會致力於開發行業標準,為醫學和生物製藥產品的開發提供臨床實驗數據和元數據的取得、交換、提交以及存檔的電子手段。
基本介紹
- 中文名:臨床數據交換標準協會
- 外文名:the Clinical Data Interchange Standards Consortium
- 簡稱:CDISC
- 性質:非盈利性機構
簡介,力量源於協作,群策群力,獨具慧眼,發展歷程,您就是CDISC,今日效率之源,未來更健康,
簡介
臨床數據交換標準協會致力於提高醫學研究及醫療保健相關領域的效率,促進公共衛生事業的持續發展。作為行業生產協作的催化劑,CDISC將醫療保健行業各相關領域進行有機結合,並發展成全球性、開放、公認的醫學研究數據標準。
CDISC,中文名稱:臨床數據交換標準協會(CDISC - the Clinical Data Interchange Standards Consortium)已經就如何收集數據、收集什麼類型的數據以及如何將數據提交給負責審批新藥的機構建立起了一套標準。CDISC將合格證書授予經過註冊的解決方案提供者,即那些它認為是合格的、具有足夠知識和經驗來執行各種CDISC標準的諮詢者、系統集成者以及學科專家。昆泰公司是第一家獲此資格的全方位藥品開發和市場服務的全球供應商。
力量源於協作
群策群力
通過共同工作並相互學習,群策群力實現我們協會,乃至整個醫療保健行業未來的目標。不斷攀升的研發成本正威脅著公共衛生事業的安全和進步。慶幸的是,是你們每個人堅持執行數據標準,幫助我們協會及公眾維護並確保臨床研究的完整性,我們行業得以蓬勃發展。
從臨床試驗起始階段便執行CDISC標準可節省啟動階段70-90%的時間和費用。對整個試驗全部資源可節省60%(不包括受試者參與時間)。效率的提高將為整個行業節省數以億計的費用,並可集中精力開發更多滿足安全、公共衛生,監管要求日益提高的產品。切實解決並促進臨床研究人員更好地共享、交換信息。
獨具慧眼
標準化有助於藥物開發全部過程(從藥物發掘階段到市場投 放階段)的合理化.對這個過程的關鍵環節生物製藥企業而 言,標準是我們共同關注的核心,也促使同行間更緊密協 作.通過我們共同地努力,可以推動行業不斷地革新和發 展. 在當前安全性日益受關注的時代,標準為我們提供共享知識 apply 庫以確保藥物安全性.在臨床研究機構,一個適用於整個臨 床試驗,高效的數據收集標準方法能幫助研究機構人員盡其 所能,發揮獨到睿智為患者提供優質的服務.
同樣地,服務和技術企業在為安全產品開發和公共衛生提供 方法,工具支持的同時也承受著越來越大的壓力.通過協作 研究,標準化有助於開發過程的合理化,同時提高數據和產 品質量,產量和客戶滿意度,也為我們贏得巨大的競爭優 勢. 自1997年成立以來,我們一直處於生物醫學研究標準開發的 前沿.CDISC聽取轉化集體的呼聲並推進引導行業發展,還通 過影響臨床前研究到臨床醫療保健整個藥物開發過程不同領 域的領軍人物,融合行業最佳實踐開發建立一系列標準.
發展歷程
2000年,32家跨國公司為了最最佳化來自醫學研究全體成員的實 踐和理念,開始著手建立一系列標準.這些公司也成為CDISC 的締造者.由此創建了這個日臻完善,全球性的非盈利組織, 用於支持臨床及臨床前數據的電子獲取,交換,遞交和歸檔。
您就是CDISC
CDISC由全球各地近200家單位組成.我們的會員包括行業領先的跨國生物技術和藥物開發公司,醫療設備和診斷設備公司,契約研究組織(CRO)和技術提供商,以及政府機構, 學術研究中心和其他非盈利組織.
今日效率之源
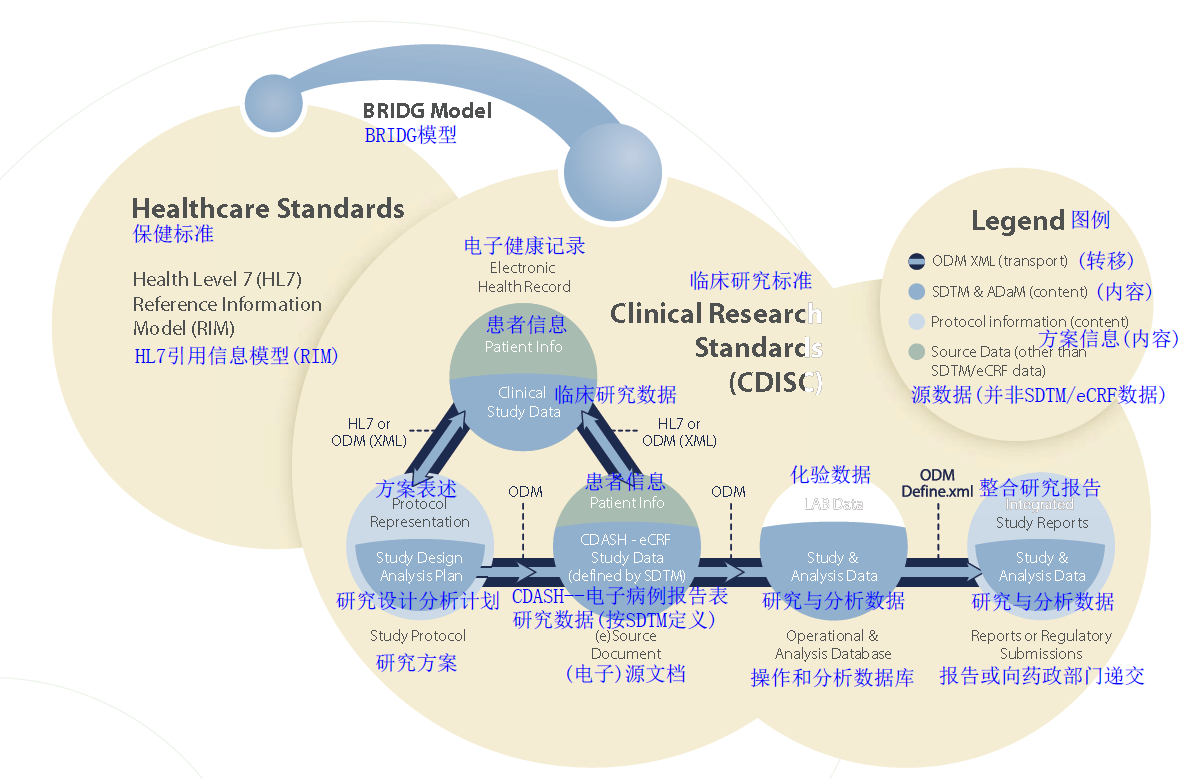
CDISC標準對臨床前和臨床研究全部過程的信息流均有推進作用,從試驗方案 設計和不同來源數據的收集到分析和報告,直至向藥政監管部門遞交和電子數據歸檔.
研究數據表格模型(SDTM)
有關臨床研究項目病例報告表數據表格, 用於向監管部門遞交的內容標準.
方案表述(PR)
用於支持臨床試驗方案信息交換的內容和格式標準,該部分與HL7聯合制定.
分析數據模型(ADaM)
有關分析數據集及相關檔案,用於向監管 部門遞交的內容標準.
運算元據模型(ODM)
基於XML,用於獲取,交換,報告或遞交, 以及對基於病例報告表(CRF)的臨床研究 數據歸檔的內容和格式標準.
化驗數據模型(LAB)
用於在臨床化驗室和研究申辦者/CRO間進 行數據轉移的內容和格式標準.
試驗設計模型(TDM)
定義了用於表述事件的計畫順序和試驗處 理計畫的結構的內容標準.該部分是SDTM 和方案表述(PR)的子集.
臨床數據獲取標準協調(CDASH)
以CDISC為指導,聯合開發的,用於病例報告表中基礎數據收集欄位的內容標準.該標準基於SDTM.
病例報告表格數據定義規範(CRTDDS)- (define.xml)
基於XML的內容和格式標準,用於CDISC SDTM數據集數據定義的規範檔案,提供給 FDA參考.該標準也稱為define.xml,是 ODM的拓展.
專業術語
全部CDISC模型/標準所涉及的標準辭彙和編碼集.
非臨床數據交換標準(SEND)
SDTM的拓展標準,用於遞交臨床前研究的數據.
辭彙表
CDISC詞典,用於解釋與臨床研究信息 電子獲取,交換,報告相關的術語及其 定義,簡稱,縮寫也列在表中.
CDISC一直在不斷壯大和發展.2001年,協會認識到這樣的需求:在臨床前和 臨床研究過程中採集的電子數據如何與臨床醫療保健過程中採集的電子數據 進行連線.為實現上述行業需求,CDISC與HL7簽署協定以實現"形成基於標 準的信息橋同時連線HL7和CDISC標準"的目標.
因此,CDISC引入臨床研究域分析模型----"生物醫學研究整合域組 (BRIDG)模型",用於協調和連線整個構架.
未來更健康
集體智慧的力量將有助於實現FDA提議的從"關鍵路徑"到"新醫學產品"的飛躍,打破墨守成規,迎接挑戰性變革.類似變革在其他地方也 時有發生,如歐盟的創新藥物計畫.通過發展和建立CDISC標準,我們共同努力實現臨床研究合理化的目標正在逐步實現.尤為突出的是,通過執行CDISC的臨床數據獲取標準協調(CDASH),無論是研究機構和研究 申辦者,還是提供商和契約研究組織(CRO)通過標準病例報告表收集臨床數據的速度大大加快.要達到真正的成功需要我們如同一個龐大科學 團體共同工作並提出解決方案.因為有您的貢獻,從"關鍵路 徑"到"新醫學產品"的飛躍和價值才能得以體現. 我們的目標是為您提供一個將來可以套用一系列已最佳化創新標準的平 — 台;同時也可獲得在數據收集,開展和報告方面的最佳實踐組合,用於 支持所有研究合作夥伴在套用各種臨床和轉化科學改善公共衛生事業時所需的必要交流。
