點腐蝕和縫隙腐蝕是金屬材料接觸某些溶液,表面上產生點狀局部腐蝕,蝕孔隨時間的延續不斷地加深,甚至穿孔,稱為點腐蝕(點蝕),也稱孔蝕。通常點蝕的蝕孔很小,直徑比深度小得多。蝕孔的最大深度與平均腐蝕深度的比值稱為點蝕係數。
基本介紹
- 中文名:點腐蝕和縫隙腐蝕
- 外文名:Pitting and crevice corrosion
- 點腐蝕簡稱:點蝕
- 類型:化學
正文
縫隙腐蝕是兩個連線物之間的縫隙處發生的腐蝕,金屬和金屬間的連線(如鉚接、螺栓連線)縫隙、金屬和非金屬間的連線縫隙,以及金屬表面上的沉積物和金屬表面之間構成的縫隙,都會出現這種局部腐蝕。
許多金屬材料都能產生點蝕和縫隙腐蝕。不鏽鋼、鋁合金等靠鈍化來增強耐蝕性的金屬材料,也易產生點蝕和縫隙腐蝕。許多環境介質都能引起金屬材料的點蝕和縫隙腐蝕,尤其是含氯離子的溶液。
點腐蝕 金屬表面的電化學不均勻性是導致點蝕的重要原因。金屬材料的表面或鈍化膜等保護層中常顯露出某些缺陷或薄弱點(如夾雜物、晶界、位錯等處),這些地方容易形成點蝕核心。金屬浸入含有某些活化陰離子(特別是氯離子)的溶液中,只要腐蝕電位達到或超過點蝕電位(或稱擊穿電位),就能產生點蝕。這是由於鈍化膜在溶液中處於溶解以及可再度形成的動平衡狀態,而溶液中的活化陰離子(氯離子)會破壞這種平衡,導致金屬的局部表面形成微小蝕點,並發展為點蝕源。例如不鏽鋼表面的硫化物夾雜的溶解,暴露出鋼的新鮮表面,就會形成點蝕源。
點蝕的發展是一個在閉塞區內的自催化過程。在有一定閉塞性的蝕孔內,溶解的金屬離子濃度大大增加,為保持電荷平衡,氯離子不斷遷入蝕孔,導致氯離子富集。高濃度的金屬氯化物水解,產生氫離子,由此造成蝕孔內的強酸性環境,又會進一步加速蝕孔內金屬的溶解和溶液氯離子濃度的增高和酸化。蝕孔內壁處於活化狀態(構成腐蝕原電池的陽極),而蝕孔外的金屬表面仍呈鈍態(構成陰極),由此形成了小陽極/大陰極的活化-鈍化電池體系,使點蝕急速發展。
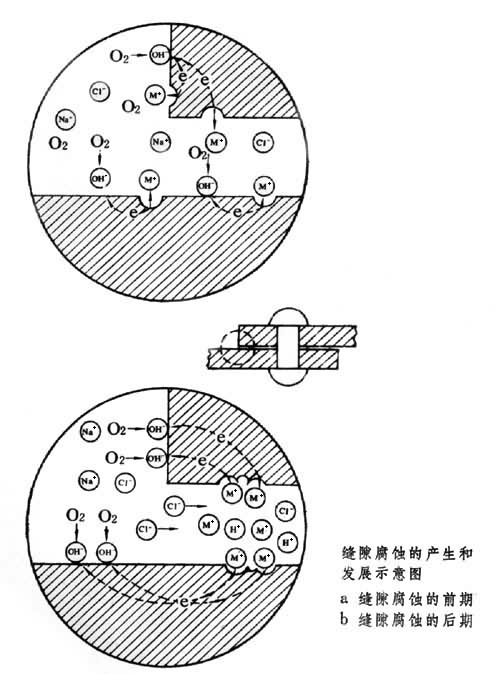
縫隙腐蝕 是由縫隙內外介質間物質移動困難所引起的。為此,縫隙的寬度應足夠狹小。它的發展也是一個閉塞區內的自催化過程。例如處在海水等介質中的鋼製零部件,在縫隙腐蝕的起始階段,縫隙內外的金屬表面都發生以氧還原作為陰極反應的腐蝕過程。由於縫隙內的溶氧很快被消耗掉,而靠擴散補充又十分困難,縫隙內氧還原的陰極反應逐漸停止,縫隙內外建立了氧濃差電池。縫隙外大面積上進行的氧還原陰極反應,則促進縫隙內金屬陽極溶解。縫隙內金屬溶解產生過剩的金屬陽離子(Me+),又使縫隙外的氯離子遷入縫隙內以保持電平衡。隨之而發生的金屬離子水解,使縫隙內酸度增高,又加速了金屬的陽極溶解(見圖)。 點腐蝕和縫隙腐蝕的比較 點腐蝕和縫隙腐蝕兩者的發展階段的機理是一致的,但是它們的誘發機理和發生過程則有所不同。前者是由於材料的鈍態或保護層的局部破壞所引起,通過形成點蝕源而發展起來的;後者則是因介質的電化學不均勻性所引起,腐蝕一開始就在縫隙條件下受閉塞電池的作用。從電極電位來看,發生和發展縫隙腐蝕的電極電位比點蝕更低。從介質來看,縫隙腐蝕在不含氯離子的溶液中也會發生,而點蝕則多在含有特殊的活性陰離子條件下才會發生。
溶液中的氯離子濃度對兩種腐蝕有很大的影響,通常是氯離子濃度愈高,點蝕和縫隙腐蝕發生的可能性也愈大,而且發展的速度也愈快。其他鹵族離子也有類似的影響。一般溶液的溫度愈高,產生點蝕和縫隙腐蝕的危險性也愈大。
防止措施 提高材料耐點蝕性的重要措施是添加適當的合金元素(如在不鏽鋼中添加鉬),採取鈍化處理及適當的熱處理,降低金屬材料中的夾雜物含量。防止縫隙腐蝕的主要措施是在結構中要避免縫隙和能造成表面沉積的幾何形狀,要儘量用焊接代替鉚接,採用非吸濕性材料做墊圈。電化學保護對防止點蝕和縫隙腐蝕都有效。採用合適的耐點蝕和耐縫隙腐蝕的金屬材料也是防止點蝕與縫隙腐蝕的有效措施。
參考書目
Localized Corrosion,National Association of Corrosion Engineers,Houston,Texas,1974.