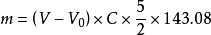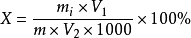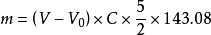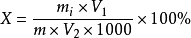直接滴定法
原理
在加熱條件下,以次甲基藍為指示劑,以已除去蛋白質的被測樣品溶液,直接滴定已標定過的費林氏液,樣品中的還原糖與斐林試劑中的酒石酸鉀鈉銅絡合物反應,生成紅色的氧化亞銅沉澱,氧化亞銅再與試劑中的亞鐵氰化鉀反應,生成可溶性化合物,到達終點時,稍過量的還原糖立即將次甲基藍還原,使藍色褪色,呈現出原樣品溶液的顏色,即為終點。根據樣品消耗體積,計算還原糖量。
本方法測定的是一大類具有還原性的糖,包括葡萄糖、果糖、乳糖、麥芽糖等,只是結果用葡萄糖或其他轉化糖表示而已。
本法是國家標準分析方法,適用於所有食品中還原糖的快速測定。檢出限0.1mg。
主要試劑
(1)費林試劑甲液:稱取15g硫酸銅(CuSO4·5H2O)及0.05g次甲基藍,溶於水中並稀釋至1L。
(2)費林試劑乙液:稱取50g酒石酸鉀鈉與75g氫氧化鈉,溶於水中,再加入4g亞鐵氰化鉀,完全溶解後,用水稀釋至500mL,貯存於橡膠塞玻璃瓶內。
(3)乙酸鋅溶液:稱取21.9g乙酸鋅,加3mL冰乙酸,加水溶解並稀釋至100mL。
(4)亞鐵氰化鉀溶液:稱取10.6g亞鐵氰化鉀,用水溶解並稀釋至100mL。
(5)葡萄糖標準溶液:精密稱取1.000g經過80℃乾燥至恆量的葡萄糖(純度在99%以上),加水溶解後,加入5mL鹽酸(目的是防腐),並以水稀釋至1L。此溶液相當於1mg/mL葡萄糖。
操作步驟
(1)樣品處理
乳類、乳製品及含蛋白質的食品:稱取約1~2g固體樣品(吸取2~10mL液體樣品),置於100mL容量瓶中,加50mL水,搖勻,邊搖邊慢慢加入5mL乙酸鋅溶液及5mL亞鐵氫化鉀溶液,加水至刻度,混勻。靜置30min,用乾燥濾紙過濾,棄去初濾液,濾液備用。
酒精性飲料:吸取50mL樣品,置於蒸發皿中,用1mol/L氫氧化鈉溶液中和至中性,在水浴上蒸發至原體積1/4後,移入100mL容量瓶中,加25mL水,混勻。以下按①中"加5mL乙酸鋅溶液"起開始操作。
含多量澱粉的食品:稱取1~2g樣品,置於100mL容量瓶中,加50mL水,在45℃水浴中加熱1h,並時時振搖(注意:此步驟為提取還原糖,切忌溫度過高,避免澱粉糊化、水解,影響結果)。冷後加水至刻度,混勻,靜置。吸取50mL上清液於另一100mL容量瓶中,以下按①中"加5mL乙酸鋅溶液"起開始操作。
汽水等含有二氧化碳的飲料:吸取50mL樣品置於蒸發皿中,在水浴上除去二氧化碳後,移入100mL容量瓶中,並用水洗滌蒸發皿,洗液併入容量瓶中,再加水至刻度,混勻後,備用。
(2)標定費林氏液溶液
吸取5.0mL費林試劑甲液及5.0mL費林試劑乙液,置於150mL錐形瓶中(甲液與乙液混合可生成氧化亞銅沉澱,因此,操作時應將甲液加入乙液,使開始生成的氧化亞銅沉澱重溶),加水10mL,玻璃珠2粒,從滴定管滴加約9mL葡萄糖標準溶液,控制在2min內加熱至沸,趁沸以每兩秒1滴的速度繼續滴加葡萄糖標準溶液,直至溶液藍色剛好褪去並出現淡黃色為終點。記錄消耗的葡萄糖標準溶液總體積,平行操作三份,取其平均值,計算每10mL(甲、乙液各5mL)斐林試劑溶液相當於葡萄糖的質量(mg)。
(3)樣品溶液預測定
吸取5.0mL費林試劑甲液及5.0mL費林試劑乙液,置於150mL錐形瓶中,加水10mL,玻璃珠2粒,控制在2min內加熱至沸,趁沸以先快後慢的速度從滴定管中滴加樣品溶液,並保持溶液沸騰狀態,待溶液顏色變淺時,以每秒一滴的速度繼續滴加,直至溶液藍色剛好褪去,並出現明亮黃色為終點。記錄樣品溶液的毫升數。
(4)樣品溶液測定
吸取5.0mL費林試劑甲液及5.0mL費林試劑乙液,置於150mL錐形瓶中,加水10mL,玻璃珠2粒,控制在2min內加熱至沸,趁沸快速從滴定管中滴加比預測體積少1mL的樣品溶液,然後趁沸繼續以每兩秒1滴的速度滴定直至終點。記錄消耗樣液的總體積,同法平行操作三份,取其平均值。
結果計算
式中:X為樣品中還原糖的含量(以葡萄糖計,%);
C為葡萄糖標準溶液的濃度(mg/mL);
m為樣品質量(g);
V為樣品定容體積(mL);
V1為滴定10mL費林氏溶液(甲、乙液各5mL)消耗葡萄糖標準溶液的體積(mL);
V2為測定時平均消耗樣品溶液的體積(mL)。
高錳酸鉀滴定法
原理
樣品經除去蛋白質後,其中還原糖在鹼性環境下將銅鹽還原為氧化亞銅,加硫酸鐵後,氧化亞銅被氧化為銅鹽,以高錳酸鉀溶液滴定氧化作用後生成的亞鐵鹽,根據高錳酸鉀消耗量計算氧化亞同含量,再查表得還原糖量。
本法為國家標準方法(GB5009.7-85),適用於所有食品中還原糖的測定以及通過酸水解或酶水解轉化成還原糖的非還原性糖類物質的測定。準確度和重現性均優於直接滴定法。
儀器
滴定管;25mL古氏坩堝或G4垂融坩堝;真空泵;水浴鍋 .
試劑
(1)6mol/L鹽酸:量取50mL鹽酸,加水稀釋至100mL。
(2)甲基紅指示劑:稱取10mg甲基紅,用100mL乙醇溶解。
(3)5mol/L氫氧化鈉溶液:稱取20g氫氧化鈉加水溶解並稀釋至100mL。
(4)鹼性酒石酸銅甲液:稱取34.639g硫酸銅(CuSO4·5H2O),加適量水溶解,加0.5mL硫酸,再加水稀釋至500mL,用精製石棉過濾。
(5)鹼性酒石酸銅乙液:稱取173g酒石酸鉀鈉與50g氫氧化鈉,加適量水溶解,並稀釋至500mL,用精製石棉過濾,貯存於橡膠塞玻璃瓶中。
(6)精製石棉:取石棉先用3mol/L鹽酸浸泡2~3天,用水洗淨,再加2.5mol/L氫氧化鈉溶液浸泡2~3天,傾去溶液,再用熱鹼性酒石酸銅已液浸泡數小時,用水洗淨。再以3mol/L鹽酸浸泡數小時,以水洗至不呈酸性。然後加水振搖,使成微細的漿狀軟縣委,用水浸泡並貯存於玻璃瓶中,即可用做填充古氏坩堝用。
(7)0.02mol/L高錳酸鉀標準溶液。
(8)硫酸鐵溶液:稱取50g硫酸鐵,加入200mL水溶解後,慢慢加入100mL硫酸,冷卻後加水稀釋至1L。
操作步驟
(1)樣品處理
按直接滴定法中樣品處理操作,丹江各項中“加入5mL乙酸鋅溶液及5mL亞鐵氫化鉀溶液”改為“加入10mL鹼性酒石酸銅甲液及4mL 1mol/L氫氧化鈉溶液”,其餘操作相同。
(2)樣品測定
吸取50mL處理後的樣品溶液,於400mL燒杯中,加入25mL鹼性酒石酸銅甲液及25mL乙液,,蓋一表面皿,加熱,控制在4min內沸騰,再準確煮沸2min,趁熱用鋪好石棉的古氏坩堝或G4垂融坩堝抽濾,並用60℃熱水洗滌燒杯及沉澱,至洗液不成鹼性為止。將古氏坩堝或G4垂融坩堝放回原400mL燒杯中,加25 mL硫酸鐵溶液及25mL水,用玻棒攪拌使氧化亞銅完全溶解,以0.02mol/L高錳酸鉀標準液滴定至微紅色為終點。
同時吸取50mL水代替樣品做空白實驗。
結果計算:
(1)樣品中還原糖質量相當於氧化亞銅的質量
式中: m為樣品中還原糖質量相當於氧化亞銅的質量(mg);
V為滴定樣品時,消耗高錳酸鉀標準液的體積(mL);
V0為滴定空白時,消耗高錳酸鉀標準液的體積(mL);
C為高錳酸鉀標準溶液的濃度(mol/L);
143.08為Cu2O的摩爾質量(g/mol)。
根據(1)式中計算所得氧化亞銅質量,由下列回歸方程可分別得出氧化亞銅質量相當於還原糖的質量(mg)。
m1=0.4388x-0.4805
m2=0.4865x-0.7268
m3=0.6856x-0.3087
m4=0.4545x-0.0327
式中:
x為氧化亞銅質量(mg);
m1為氧化亞銅質量相當於葡萄糖的質量(mg);
m2為氧化亞銅質量相當於果糖的質量(mg);
m3為氧化亞銅質量相當於乳糖的質量(mg);
m4為氧化亞銅質量相當於轉化糖的質量(mg)。
(2)還原糖
mi為m1或m2或m3或m4;
V1為樣品處理液總體積(mL);
V2為測定用樣品溶液體積(mL)。