高錳酸鉀滴定法(Potassium Permanganate titration),以高錳酸鉀為滴定劑的氧化還原滴定法。
基本介紹
- 中文名:高錳酸鉀滴定法
- 外文名:Potassium Permanganate titration
- 解釋:高錳酸鉀溶液作滴定劑容量分析
- 類型:一種氧化還原法
定義
基本原理

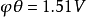
標準溶液配製
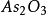
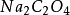
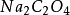
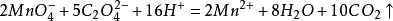
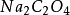
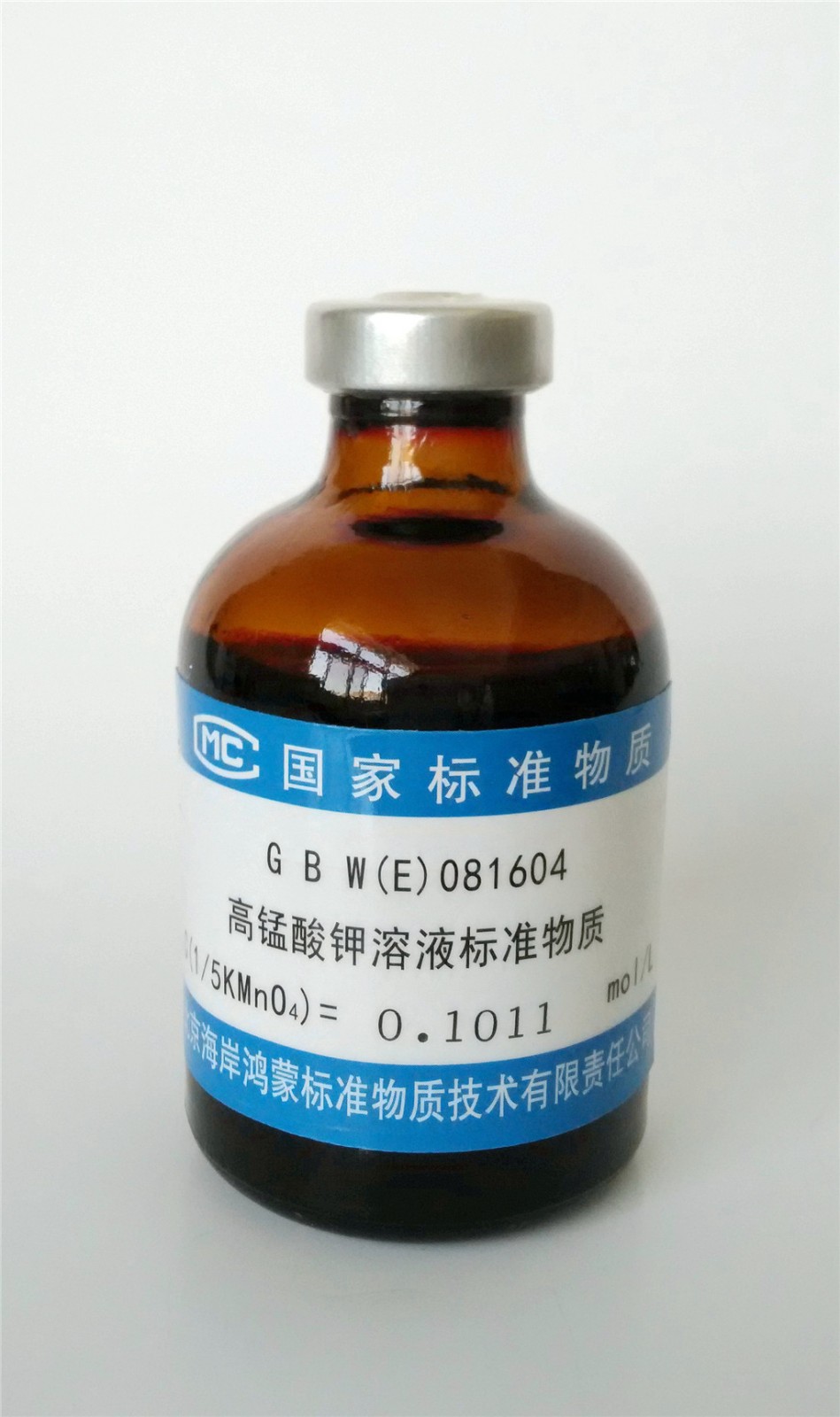
高錳酸鉀滴定法(Potassium Permanganate titration),以高錳酸鉀為滴定劑的氧化還原滴定法。

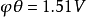
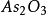
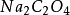
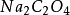
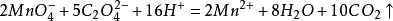
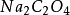
高錳酸鉀滴定法(Potassium Permanganate titration),以高錳酸鉀為滴定劑的氧化還原滴定法。...
如高錳酸鉀標準滴定溶液滴定產品草酸時,滴定終點為高錳酸鉀標準滴定溶液的紫色。 [4] 氧化還原滴定法預先操作 編輯 在氧化還原滴定中,往往需要在滴定之前,先將被...
3、氧化還原滴定法:以氧化還原反應為基礎的一種滴定分析方法。高錳酸鉀測定鐵含量;4、沉澱滴定法:以沉澱反應為基礎的一種滴定分析方法。例如食鹽中氯的測定。...
重鉻酸鉀滴定法是用重鉻酸鉀作滴定劑的一種氧化還原滴定法。在強酸性溶液中,Cr2O72-被還原為Cr3+。與高錳酸鉀法比較,在室溫和1mol/L鹽酸條件下,重鉻酸鉀不與Cl...
高錳酸鹽指數是指在一定條件下,以高錳酸鉀(KMnO4)為氧化劑,處理水樣時所消耗的氧化劑的量。表示單位氧的毫克/升(O2,mg/l)。...
滴定管是滴定分析法所用的主要量器、滴定管的容積與其所標出的體積並非完全一致...凡是能與橡皮管起反應的溶液,如高錳酸鉀、碘等溶液,都不能裝入鹼式滴定管中。...
《GB/T 1608-2008 工業高錳酸鉀》由中華人民共和國國家質量監督檢驗檢疫總局與中國國家標準化管理委員會於2008年5月14日發布,並於2008年10月1日正式實施。本標準...
根據高錳酸鉀滴定液(0.02mol/L)的消耗量,算出本液的濃度,即得。 如需用草酸滴定液(0.25mol/L)時,可取草酸約32g,照上法配製與標定,但改用高錳酸鉀滴定液...
滴定對象:Pd²﹢、Cd²﹢、Zn²﹢、Ba²﹢等。電位滴定法還原滴定 參比電極:甘汞電極;指示電極:鉑電極;(1)標準溶液:高錳酸鉀;...
化學滴定分析答案、滴定分析法的準確度比較高,其相對誤差約為±0.2%。...... 以這些反應為基礎建立了高錳酸鉀(滴定)法。KMnO4氧化力強,套用廣泛,以KMnO4為滴定...
高錳酸鹽又名過錳酸鹽,是指所有陰離子為高錳酸根離子(MnO4-)的鹽類的總稱,其中錳元素的化合價為+7價。高錳酸鹽指數的測定都是以高錳酸鉀為氧化劑,根據測定...
高錳酸鹽指數(IMn)以每升樣品消耗毫克氧數來表示(O2,mg/L),按式(1)計算。式中:V1——樣品滴定(7.2)時,消耗高錳酸鉀溶液體積,mL;...
附錄A(資料性附錄)滴定法測量結果不確定度評定實例 A.1例1重鉻酸鉀、硫酸亞鐵銨、高錳酸鉀標準溶液的不確定度評定 A.2例2不鏽鋼中鉻含量測定的不確定度評定...
這類糖稱為還原糖。單糖均是還原糖,雙糖中的乳糖、麥芽糖也具有還原性。還原糖常用的測定方法有直接滴定法、高錳酸鉀滴定法和比色法。 ...
根據茶多酚易氧化、對某些試劑顯色的特性,國內外常用高錳酸鉀滴定法(Iowenthal-Neubaur法)和比色法。前者是套用靛紅(指示劑)存在時高錳酸鉀對茶多酚氧化,根據高...
第五章 氧化還原滴定第一節 亞鐵鹽中鐵含量的測定(重鉻酸鉀法)第二節 水樣中化學耗氧量(COD)的測定(重鉻酸鉀法)第三節 過氧化氫含量的測定(高錳酸鉀法)...
實驗五十 肥皂和洗滌劑中EDTA(絡合劑)含量的測定——硫酸銅滴定法實驗五十一 洗衣粉中活性氧含量的測定——高錳酸鉀滴定法實驗五十二 電鍍用硫酸銅的測定——...
實驗七鉛鉍混合液中鉛、鉍含量的連續滴定43實驗八高錳酸鉀標準溶液的配製與標定44實驗九高錳酸鉀法測定過氧化氫的含量46實驗十高錳酸鉀間接滴定法測定鈣的含量48...
