類克(注射用英夫利西單抗),適應症為:
類風濕關節炎,本品是疾病控制性抗風濕藥物。對於中重度活動性類風濕關節炎患者,本品與甲氨蝶呤合用可用於:減輕症狀和體徵;改善身體機能,預防患者殘疾。
克羅恩病,對於接受傳統治療效果不佳的中重度活動性克羅恩病患者,本品可用於:減輕症狀和體徵;達到並維持臨床療效;促進黏膜癒合;改善生活質量;使患者減少皮質激素用量或停止使用皮質激素。瘺管性克羅恩病對於瘺管性克羅恩病患者,本品可用於:減少腸-皮膚瘺管和直腸-陰道瘺管的數量,促進並維持瘺管癒合;減輕症狀和體徵;改善生活質量。強直性脊柱炎對於活動性強直性脊柱炎患者,本品可用於:減輕症狀和體徵,包括增加活動幅度;改善身體機能;改善生活質量。
銀屑病,對於銀屑病患者,本品可用於:需系統治療且對環孢黴素、甲氨蝶呤或光化學療法等其它系統治療無效、禁忌或耐受的慢性重度斑塊型銀屑病成年患者。本品僅用於能在醫師的密切監測下進行治療並由醫生進行定期隨訪的患者。
基本介紹
- 藥品名稱:類克?
- 藥品類型:處方藥
成份,性狀,適應症,規格,用法用量,不良反應,禁忌,注意事項,孕婦及哺乳期婦女用藥,兒童用藥,老年用藥,藥物相互作用,藥物過量,藥理毒理,藥代動力學,貯藏,包裝,有效期,執行標準,生產企業,核准日期,修訂日期,
成份
主要成份:英夫利西單抗
輔料:蔗糖、吐溫80、磷酸二氫鈉(或磷酸二氫鈉一水合物)、磷酸氫二鈉(或磷酸氫二鈉一水合物)
輔料:蔗糖、吐溫80、磷酸二氫鈉(或磷酸二氫鈉一水合物)、磷酸氫二鈉(或磷酸氫二鈉一水合物)
性狀
本品為白色固體,溶解後為無色至淡黃色液體,泛乳白色光,無異物。
適應症
類風濕關節炎
本品是疾病控制性抗風濕藥物。對於中重度活動性類風濕關節炎患者,本品與甲氨蝶呤合用可用於:
·減輕症狀和體徵;
·改善身體機能,預防患者殘疾。
克羅恩病
對於接受傳統治療效果不佳的中重度活動性克羅恩病患者,本品可用於:
·減輕症狀和體徵;
·達到並維持臨床療效;
·促進黏膜癒合;
·改善生活質量;
·使患者減少皮質激素用量或停止使用皮質激素。
瘺管性克羅恩病
對於瘺管性克羅恩病患者,本品可用於:
·減少腸-皮膚瘺管和直腸-陰道瘺管的數量,促進並維持瘺管癒合;
·減輕症狀和體徵;
·改善生活質量。
強直性脊柱炎
對於活動性強直性脊柱炎患者,本品可用於:
·減輕症狀和體徵,包括增加活動幅度;
·改善身體機能;
·改善生活質量。
本品是疾病控制性抗風濕藥物。對於中重度活動性類風濕關節炎患者,本品與甲氨蝶呤合用可用於:
·減輕症狀和體徵;
·改善身體機能,預防患者殘疾。
克羅恩病
對於接受傳統治療效果不佳的中重度活動性克羅恩病患者,本品可用於:
·減輕症狀和體徵;
·達到並維持臨床療效;
·促進黏膜癒合;
·改善生活質量;
·使患者減少皮質激素用量或停止使用皮質激素。
瘺管性克羅恩病
對於瘺管性克羅恩病患者,本品可用於:
·減少腸-皮膚瘺管和直腸-陰道瘺管的數量,促進並維持瘺管癒合;
·減輕症狀和體徵;
·改善生活質量。
強直性脊柱炎
對於活動性強直性脊柱炎患者,本品可用於:
·減輕症狀和體徵,包括增加活動幅度;
·改善身體機能;
·改善生活質量。
銀屑病
對於銀屑病患者,本品可用於:
需系統治療且對環孢黴素、甲氨蝶呤或光化學療法等其它系統治療無效、禁忌或耐受的慢性重度斑塊型銀屑病成年患者。本品僅用於能在醫師的密切監測下進行治療並由醫生進行定期隨訪的患者。
規格
100mg/瓶
用法用量
用法:靜脈輸注。
用量:
類風濕關節炎
首次給予本品3mg/kg,然後在首次給藥後的第2周和第6周及以後每隔8周各給予一次相同劑量。本品應與甲氨蝶吟合用。對於療效不佳的患者,可考慮將劑量調整至10mg/kg,和/或將用藥間隔調整為4周。
中重度活動性克羅恩病、瘺管性克羅恩病
首次給予本品5mg/kg,然後在首次給藥後的第2周和第6周及以後每隔8周各給予一次相同劑量。對於療效不佳的患者,可考慮將劑量調整至l0mg/kg。
用量:
類風濕關節炎
首次給予本品3mg/kg,然後在首次給藥後的第2周和第6周及以後每隔8周各給予一次相同劑量。本品應與甲氨蝶吟合用。對於療效不佳的患者,可考慮將劑量調整至10mg/kg,和/或將用藥間隔調整為4周。
中重度活動性克羅恩病、瘺管性克羅恩病
首次給予本品5mg/kg,然後在首次給藥後的第2周和第6周及以後每隔8周各給予一次相同劑量。對於療效不佳的患者,可考慮將劑量調整至l0mg/kg。
強直性脊柱炎
首次給予本品5mg/kg,然後在首次給藥後的第2周和第6周及以後每隔6周各給予一次相同劑量。
使用指導
應進行無菌操作。
1.計算劑量,確定本品的使用瓶數:本品每瓶含英夫利西單抗100mg,計算所需配製的本品溶液總量。
2.使用配有21號(0.8mm)或更小針頭的注射器,將每瓶藥品用10ml無菌注射用水溶解:除去藥瓶的翻蓋,用醫用酒精棉簽擦拭藥瓶頂部,將注射器針頭插入藥瓶膠蓋,注入無菌注射用水。如藥瓶內的真空狀態已被破壞,則該瓶藥品不能使用。輕輕旋轉藥瓶,使藥粉溶解。避免長時間或用力搖晃,嚴禁振盪。溶藥過程中可能出現泡沫,放置5分鐘後,溶液應為無色或淡黃色,泛乳白色光。由於英夫利西單抗是一種蛋白質,溶液中可能會有一些半透明微粒。如果溶液中出現不透明顆粒、變色或其它物質,則不能繼續使用。
3.用0.9%氯化鈉注射液將本品的無菌注射用水溶液稀釋至250ml:從250ml 0.9%氯化鈉注射液瓶或袋中抽出與本品的無菌注射用水溶液相同的液體量,將本品的無菌注射用水溶液全部注入該輸液瓶或袋中,輕輕混合。
4.輸液時間不得少於2小時:輸液裝置上應配有一個內置的、無菌、無熱原、低蛋白結合率的濾膜(孔徑≤1.2μm)。未用完的輸液不應再貯存使用。
5.未進行本品與其它藥物合用的物理生化兼容性研究,本品不應與其它藥物同時進行輸液。
經胃腸道外給藥的產品在給藥前應目檢是否存在微粒物質或變色現象。如果發現存在不透明顆粒、變色或其它異物,則該藥品不可使用。
斑塊型銀屑病
首次給予本品5mg/kg,然後在首次給藥後的第2周和第6周及以後每隔8周各給予一次相同劑量。若患者在第14周后(即4次給藥後)沒有應答,不應繼續給予本品治療。
銀屑病患者再次給藥
銀屑病患者相隔20周后再次單次給藥的經驗有限,與最初的誘導治療相比,提示本品的有效性降低,且輕到中度輸液反應增加。
疾病復發後,有限的反覆誘導治療經驗表明,與8周維持治療相比,輸液反應增加(包括嚴重反應)。
如維持治療中斷,不推薦再次啟動誘導治療,應按照維持治療再次給藥。
不良反應
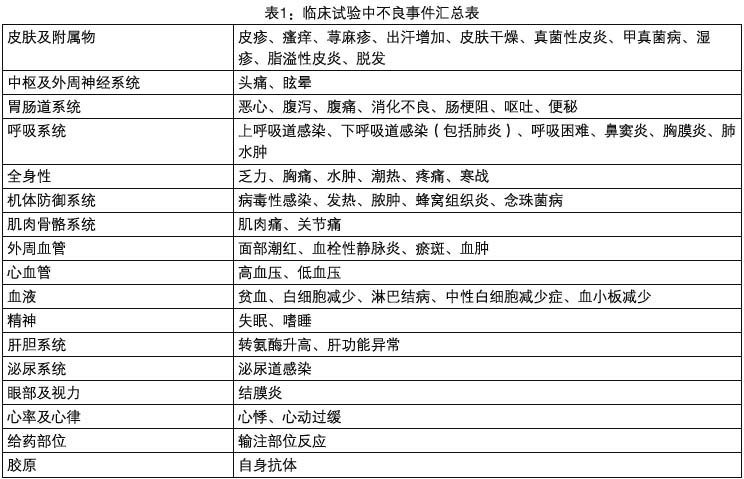
安全性資料來源於5159名接受本品治療的患者的臨床試驗,其中類風濕關節炎1304名,青少年類風濕關節炎117名,克羅恩病1224名(包括成人1085名和兒童139名),強直性脊柱炎347名,銀屑病型關節炎293名,斑塊狀銀屑病1373名,潰瘍性結腸炎484名,其它疾病17名。試驗中的不良反應列於表1。除潰瘍性結腸炎、兒童克羅恩病和斑塊狀銀屑病患者外,輸液反應(如呼吸困難、面色潮紅、頭痛和皮疹)是患者停藥的主要原因。
輸液反應
在臨床試驗中,輸液中和輸液結束後的2小時內,安慰劑組患者中有10%發生與輸液相關的反應,本品組患者中有20%發生該反應。其中約有3%出現發熱或寒戰等非特異性症狀,低於1%出現瘙癢或蕁麻疹,1%出現心肺反應(主要表現為胸痛、低血壓、高血壓或呼吸困難)或瘙癢、蕁麻疹和心肺反應的合併症狀。約有低於1%的患者出現了包括過敏、驚厥、紅斑和低血壓在內的嚴重輸液反應。約3%的患者因與輸液相關的反應而中斷治療。所有發生上述反應的患者無論接受治療與否,均全部恢復。
在一項類風濕關節炎臨床試驗(ASPIRE)中66%(1040名中有686名)的患者至少接受過1次不超過90分鐘的短時間輸注,其中44%(1040名中有454名)的患者至少接受過1次不超過60分鐘的短時間輸注。至少接受過1次短時間輸注的本品組有15%(74/494)的患者發生了輸液反應,0.4%(2/494)的患者發生了嚴重輸液反應。尚未進行劑量大於6mg/kg的短時間輸注研究。
本品上市後監察顯示有過敏樣反應的報告,包括喉頭水腫、咽水腫和嚴重支氣管痙攣,未見與這些反應相關的死亡病例。罕見與本品相關的癲癇發作的報告。
再次給藥後的遲發性過敏/遲發性反應
根據國外文獻,在一項臨床研究中,41名克羅恩病患者中有37名在停用本品2至4年後,再次接受本品的治療,有10名患者在輸液後3-12天內發生不良事件,其中6名較嚴重。症狀和體徵包括:肌肉痛和/或關節痛伴有發熱和/或皮疹,一些患者還出現瘙癢;面部、手部和唇部浮腫;吞咽困難;蕁麻疹;咽喉痛;頭痛。發生這些不良事件的患者在首次接受本品治療時未發生過與輸液有關的不良事件。在這37名患者中,以前使用過英夫利西單抗液體製劑的23名患者中有9名(39%)發生了不良事件;在以前使用過英夫利西單抗凍乾粉劑的14名患者中僅1名(7%)發生了不良事件。尚無足夠的臨床證據表明這些反應的發生是由於劑型不同而引起。患者的症狀和體徵經過治療均得到改善和消除。由於停藥1-2年的患者資料不足,無法確定此類不良事件的發生率。在臨床試驗和上市後監察中,用藥間隔少於1年的患者罕有發生此類不良事件。3項銀屑病試驗中,1%(15/1373)的患者出現關節痛、血清病、肌痛、發熱和皮疹,但這些不良反應通常發生在本品使用後的初期。在多數病例中停止使用本品和/或使用其他療法後症狀和體徵可改善或消退。
免疫原性
對本品產生抗體的患者發生與輸液相關反應的可能性較大(約為2-3倍),合用免疫抑制劑可降低產生本品抗體以及與輸液相關反應的發生率。給藥3次後繼續接受維持治療的患者中,約有10%產生了本品的抗體。在停藥期大於16周后使用本品的克羅恩病患者本品抗體的產生率較高。一項3期銀屑病型關節炎試驗中,無論合用甲氨蝶呤與否,接受本品5 mg/kg的患者中15%出現了本品的抗體。2項銀屑病3期臨床試驗中,給予本品進行誘導治療及其後的維持治療且未合用免疫抑制劑。在以上試驗中,在每隔8周接受一次本品5 mg/kg且持續治療1年的患者中,近25-30%的患者出現了本品的抗體,高於(至1.6倍)其他治療方案(每隔8周給予本品3 mg/kg,必要時給予本品3 mg/kg,必要時給予本品5 mg/kg)的該比率。儘管出現自身抗體的比例增加了,但在這2項3期銀屑病試驗中,給予本品5 mg/kg,隨後每隔8周給藥維持治療1年的患者中,輸液反應發生率(14.1%-23.0%)和嚴重輸液反應發生率([1%)與在其他試驗人群中觀察到的相似。
感染
在多項臨床研究中,本品組患者的感染率為36%,安慰劑組患者的感染率為28%。在克羅恩病臨床研究中,與安慰劑比較,未觀察到本品可增加嚴重感染的風險。在類風濕關節炎臨床試驗中,在包括肺炎在內的嚴重感染髮生率上,本品+甲氨蝶呤合用組高於甲氨蝶呤單用組,此現象尤其出現在劑量在6mg/kg或以上時。在銀屑病試驗中,接受本品患者(平均隨訪41.9周)的1.5%和接受安慰劑患者(平均隨訪18.1周)的0.6%發生了嚴重感染。
根據藥品上市後經驗,曾觀察到一些病原體(包括病毒、細菌、真菌及原蟲)引起的感染病例,感染病灶涉及多個器官系統。這些感染患者或單獨使用了本品,或合併使用了免疫抑制劑。
肝膽系統
在本品上市後經驗中有非常罕見的黃疸和肝炎(其中一些具有自身免疫性肝炎的特徵)的病例報告。
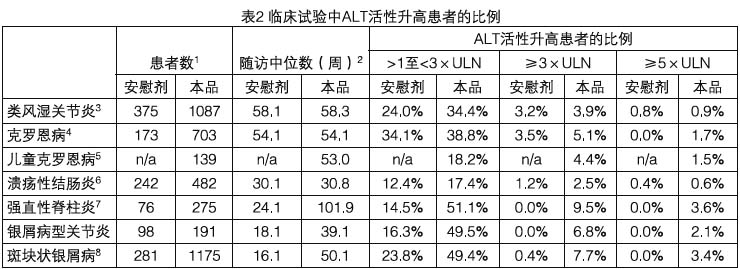
在臨床試驗中,觀察到了使用本品的患者出現中重度谷丙轉氨酶(ALT)和穀草轉氨酶(AST)升高,但未導致嚴重肝損傷。ALT升高至正常範圍上限(ULN)的5倍或以上(見表2)。本品組(單用或與其它免疫抑制劑合用)患者轉氨酶(ALT比AST更常見)升高比例高於對照組(見表2)。大多數轉氨酶異常是一過性的,但少數患者轉氨酶升高的時間較長。一般情況下,ALT和AST升高的患者均未出現症狀,在繼續使用本品、停用本品或調整合併用藥後,該異常現象可減輕或消除。
1 ALT評估的患者數。
2 隨訪中位數是依據經治患者的數據。
3 安慰劑組只接受甲氨蝶呤,本品組合用甲氨蝶呤。
4 在2項治療克羅恩病的3期試驗C0168T21、C0168T26中,安慰劑組患者在試驗開始接受了本品5 mg/kg後,在維持期一直接受安慰劑。進行ALT分析時,隨機分入安慰劑維持組後又交叉使用本品的患者數據也屬於本品組。
5 患者來源於治療兒童克羅恩病的T23、T55和T47試驗。隨訪中位數為53.0周。
6 患者來源於治療潰瘍性結腸炎的C0168T37和C0168T46試驗。隨訪中位數在安慰劑組為30周,本品合用治療組為31周。
7 數據來自C0168T51試驗。
8 ALT值來源於2項治療銀屑病的3期試驗C0168T38、C0168T44。
惡性腫瘤
在臨床試驗中,有本品組患者出現新生或復發惡性腫瘤的報告。淋巴瘤的發生率高於正常人群的預期值。雖然對照組的發生率低於正常人群的預期值,但是本品組觀察到的非-淋巴瘤的惡性腫瘤與正常人群的預期值相似。在一項探索性臨床試驗中,納入了吸菸或已戒菸的中重度慢性阻塞性肺病(COPD)患者,本品組發生惡性腫瘤的病例報告多於對照組。尚未知TNF抑制劑對惡性腫瘤發生的潛在作用。
抗核抗體(ANA)/抗雙鏈脫氧核糖核酸(dsDNA)抗體
臨床試驗中,基線時ANA陰性的本品組患者約有一半在治療中ANA呈陽性,此現象在安慰劑組患者中的發生率約為20%。在本品組患者中抗dsDNA抗體的轉陽率約為17%,而在安慰劑組患者中為0%。少見狼瘡及狼瘡樣綜合徵的報告。
充血性心力衰竭
在一項評價本品對中重度心力衰竭(紐約心臟學會Ⅲ/Ⅳ級且左心室射血分數≤35%)的Ⅱ期臨床研究中,將150名患者隨機分為3組:10mg/kg本品組51名、5mg/kg本品組50名、安慰劑組49名,每組接受3次輸液治療,可觀察到10mg/kg本品組因心力衰竭加重而死亡和住院的發生率較高。在第28周時,10mg/kg本品組有3例患者死亡,5mg/kg本品組有1例患者死亡,安慰劑組無死亡。在同一時間點時,因心力衰竭加重而住院的病例數,10mg/kg本品組有11例,5mg/kg本品組有3例,安慰劑組有5例。在隨訪的第1年死亡的病例數,10mg/kg本品組有8例,5mg/kg本品組和安慰劑組各有4例。尚未研究本品對輕度心力衰竭(紐約心臟學會Ⅰ/Ⅱ級)的影響。上市後經驗顯示,使用本品的患者(無論有無明顯誘發因素)有心力衰竭加重的報告。
罕見初發性心力衰竭(包括無已知既往心血管疾病的患者出現的心力衰竭)報告,其中一些患者的年齡在50歲以下。
青少年類風濕關節炎
在一項14周的多中心、隨機、雙盲、安慰劑對照及其後最長至第44周的雙盲、全活性藥物延長治療試驗中評價了本品的安全性和有效性。共有122名年齡在4-17歲之間的活動性青少年類風濕關節炎患者入組,他們都曾使用了至少3個月的甲氨蝶呤,其中有120名患者接受了研究藥物的治療。同時允許其服用葉酸、口服皮質激素(≤10 mg/天)、非甾體類抗炎藥和/或甲氨蝶呤。
第0、2、6、14、20周靜脈輸注3 mg/kg的本品或安慰劑,隨後每隔8周給藥1次至第44周。為保持盲法治療,3 mg/kg劑量組的患者還在第16周接受了一次單劑量的安慰劑,隨機分入安慰劑組的患者在第14、16、20周交叉接受了6 mg/kg的本品,每隔8周給藥一次至第44周。本品用於青少年類風濕關節炎患兒的有效性和安全性尚未確定。接受本品3 mg/kg合用甲氨蝶呤的60名青少年類風濕關節炎患兒中有41名(68.3%)在觀察52周后發生了感染,接受本品6 mg/kg合用甲氨蝶呤的57名青少年類風濕關節炎患兒中有37名(64.9%)在觀察38周后發生了感染,接受安慰劑合用甲氨蝶呤的60名青少年類風濕關節炎患兒中有28名(46.7%)在觀察14周后出現感染。最常報告的感染是上呼吸道和咽炎,最常報告的嚴重感染是肺炎。其他值得關注的感染是1例原發性水痘和1例帶狀皰疹。接受本品3 mg/kg的青少年類風濕關節炎患兒輸液反應的發生率為35.0%,6 mg/kg組為17.5%。最常報告的輸液反應是噁心、發熱、頭痛和低血壓。本品3 mg/kg組中4人發生了嚴重輸液反應,3人報告出現了可能的過敏性反應(其中2人是發生嚴重輸液反應者)。本品6 mg/kg組中有2人發生嚴重輸液反應,其中1人出現可能的過敏性反應。出現嚴重輸液反應的6人中有2人快速輸注(輸注時間少於2小時)了本品。3 mg/kg組有37.7%的青少年類風濕關節炎患兒出現了本品的抗體,6 mg/kg組為12.2%。而且3 mg/kg組的抗體效價明顯高於6 mg/kg組。
兒童克羅恩病
一般而言,接受本品的克羅恩病患兒出現不良事件的頻率和種類與成年克羅恩患者相似。下文中討論了區別於成人的不良事件及其他需考慮的特殊事項。
與385名接受相似療法的成年克羅恩病患者相比,更常報告於103名接受本品5 mg/kg治療54周的克羅恩病患兒中的不良事件包括 :貧血(10.7%)、血便(9.7%)、白細胞減少(8.7%)、潮紅(8.7%)、病毒性感染(7.8%)、中性粒細胞減少症(6.8%)、骨折(6.8%)、細菌性感染(5.8%)、呼吸道過敏反應(5.8%)。
在REACH試驗中56.3%的患者和ACCENT1試驗中5 mg/kg本品組50.3%的患者出現了感染。在REACH試驗中,每隔8周給藥患者的感染髮生率高於每隔12周組(分別為73.6%和38.0%),但是3名每隔8周給藥的患者和4名每隔12周給藥的患者出現了嚴重感染。最常報告的感染是上呼吸道感染和咽炎,最常報告的嚴重感染是膿腫。3名患者報告感染了肺炎,其中2名是每隔8周維持給藥的患者,1名是每隔12周維持給藥的患者。每隔8周維持治療組報告有2例患者發生了帶狀皰疹。總之,REACH試驗中17.5%的患者至少出現了1次輸液反應,其中每隔8周維持給藥組為17.0%,每隔12周組為18.0%。但是未出現嚴重的輸液反應,僅有2名患者出現了非嚴重性過敏反應。3名(2.9%)克羅恩病患兒出現了本品的抗體。
上市後用藥經驗
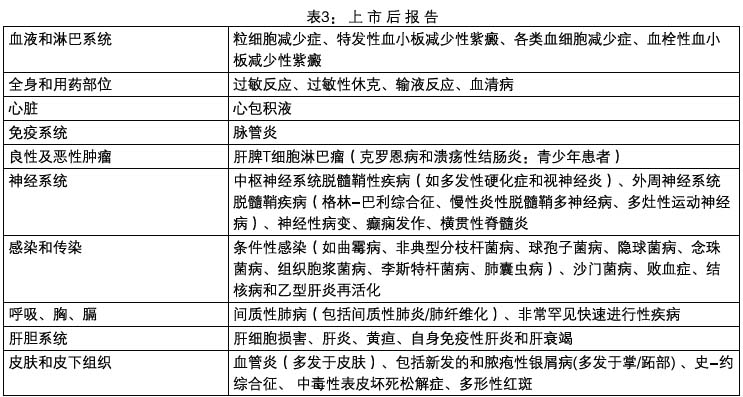
本品在全球範圍內上市後用藥經驗中報告的其他不良事件(某些可能導致死亡)列於下表。由於這些事件均來源於自發性報告,總體用藥人數不詳,因此不能明確判斷其發生率或確定與本品的相關性。
上市後最常見報告自兒童的嚴重不良事件是感染(某些可導致死亡),包括條件致病菌的感染和結核病、輸液反應和過敏性反應。上市後兒童的嚴重不良事件自發報告還包括惡性腫瘤、一過性肝酶異常、狼瘡樣綜合徵和自身抗體陽性。
罕見接受本品治療的克羅恩病青少年患者出現肝脾T細胞淋巴瘤。
輸液反應
在臨床試驗中,輸液中和輸液結束後的2小時內,安慰劑組患者中有10%發生與輸液相關的反應,本品組患者中有20%發生該反應。其中約有3%出現發熱或寒戰等非特異性症狀,低於1%出現瘙癢或蕁麻疹,1%出現心肺反應(主要表現為胸痛、低血壓、高血壓或呼吸困難)或瘙癢、蕁麻疹和心肺反應的合併症狀。約有低於1%的患者出現了包括過敏、驚厥、紅斑和低血壓在內的嚴重輸液反應。約3%的患者因與輸液相關的反應而中斷治療。所有發生上述反應的患者無論接受治療與否,均全部恢復。
在一項類風濕關節炎臨床試驗(ASPIRE)中66%(1040名中有686名)的患者至少接受過1次不超過90分鐘的短時間輸注,其中44%(1040名中有454名)的患者至少接受過1次不超過60分鐘的短時間輸注。至少接受過1次短時間輸注的本品組有15%(74/494)的患者發生了輸液反應,0.4%(2/494)的患者發生了嚴重輸液反應。尚未進行劑量大於6mg/kg的短時間輸注研究。
本品上市後監察顯示有過敏樣反應的報告,包括喉頭水腫、咽水腫和嚴重支氣管痙攣,未見與這些反應相關的死亡病例。罕見與本品相關的癲癇發作的報告。
再次給藥後的遲發性過敏/遲發性反應
根據國外文獻,在一項臨床研究中,41名克羅恩病患者中有37名在停用本品2至4年後,再次接受本品的治療,有10名患者在輸液後3-12天內發生不良事件,其中6名較嚴重。症狀和體徵包括:肌肉痛和/或關節痛伴有發熱和/或皮疹,一些患者還出現瘙癢;面部、手部和唇部浮腫;吞咽困難;蕁麻疹;咽喉痛;頭痛。發生這些不良事件的患者在首次接受本品治療時未發生過與輸液有關的不良事件。在這37名患者中,以前使用過英夫利西單抗液體製劑的23名患者中有9名(39%)發生了不良事件;在以前使用過英夫利西單抗凍乾粉劑的14名患者中僅1名(7%)發生了不良事件。尚無足夠的臨床證據表明這些反應的發生是由於劑型不同而引起。患者的症狀和體徵經過治療均得到改善和消除。由於停藥1-2年的患者資料不足,無法確定此類不良事件的發生率。在臨床試驗和上市後監察中,用藥間隔少於1年的患者罕有發生此類不良事件。3項銀屑病試驗中,1%(15/1373)的患者出現關節痛、血清病、肌痛、發熱和皮疹,但這些不良反應通常發生在本品使用後的初期。在多數病例中停止使用本品和/或使用其他療法後症狀和體徵可改善或消退。
免疫原性
對本品產生抗體的患者發生與輸液相關反應的可能性較大(約為2-3倍),合用免疫抑制劑可降低產生本品抗體以及與輸液相關反應的發生率。給藥3次後繼續接受維持治療的患者中,約有10%產生了本品的抗體。在停藥期大於16周后使用本品的克羅恩病患者本品抗體的產生率較高。一項3期銀屑病型關節炎試驗中,無論合用甲氨蝶呤與否,接受本品5 mg/kg的患者中15%出現了本品的抗體。2項銀屑病3期臨床試驗中,給予本品進行誘導治療及其後的維持治療且未合用免疫抑制劑。在以上試驗中,在每隔8周接受一次本品5 mg/kg且持續治療1年的患者中,近25-30%的患者出現了本品的抗體,高於(至1.6倍)其他治療方案(每隔8周給予本品3 mg/kg,必要時給予本品3 mg/kg,必要時給予本品5 mg/kg)的該比率。儘管出現自身抗體的比例增加了,但在這2項3期銀屑病試驗中,給予本品5 mg/kg,隨後每隔8周給藥維持治療1年的患者中,輸液反應發生率(14.1%-23.0%)和嚴重輸液反應發生率([1%)與在其他試驗人群中觀察到的相似。
感染
在多項臨床研究中,本品組患者的感染率為36%,安慰劑組患者的感染率為28%。在克羅恩病臨床研究中,與安慰劑比較,未觀察到本品可增加嚴重感染的風險。在類風濕關節炎臨床試驗中,在包括肺炎在內的嚴重感染髮生率上,本品+甲氨蝶呤合用組高於甲氨蝶呤單用組,此現象尤其出現在劑量在6mg/kg或以上時。在銀屑病試驗中,接受本品患者(平均隨訪41.9周)的1.5%和接受安慰劑患者(平均隨訪18.1周)的0.6%發生了嚴重感染。
根據藥品上市後經驗,曾觀察到一些病原體(包括病毒、細菌、真菌及原蟲)引起的感染病例,感染病灶涉及多個器官系統。這些感染患者或單獨使用了本品,或合併使用了免疫抑制劑。
肝膽系統
在本品上市後經驗中有非常罕見的黃疸和肝炎(其中一些具有自身免疫性肝炎的特徵)的病例報告。
在臨床試驗中,觀察到了使用本品的患者出現中重度谷丙轉氨酶(ALT)和穀草轉氨酶(AST)升高,但未導致嚴重肝損傷。ALT升高至正常範圍上限(ULN)的5倍或以上(見表2)。本品組(單用或與其它免疫抑制劑合用)患者轉氨酶(ALT比AST更常見)升高比例高於對照組(見表2)。大多數轉氨酶異常是一過性的,但少數患者轉氨酶升高的時間較長。一般情況下,ALT和AST升高的患者均未出現症狀,在繼續使用本品、停用本品或調整合併用藥後,該異常現象可減輕或消除。
1 ALT評估的患者數。
2 隨訪中位數是依據經治患者的數據。
3 安慰劑組只接受甲氨蝶呤,本品組合用甲氨蝶呤。
4 在2項治療克羅恩病的3期試驗C0168T21、C0168T26中,安慰劑組患者在試驗開始接受了本品5 mg/kg後,在維持期一直接受安慰劑。進行ALT分析時,隨機分入安慰劑維持組後又交叉使用本品的患者數據也屬於本品組。
5 患者來源於治療兒童克羅恩病的T23、T55和T47試驗。隨訪中位數為53.0周。
6 患者來源於治療潰瘍性結腸炎的C0168T37和C0168T46試驗。隨訪中位數在安慰劑組為30周,本品合用治療組為31周。
7 數據來自C0168T51試驗。
8 ALT值來源於2項治療銀屑病的3期試驗C0168T38、C0168T44。
惡性腫瘤
在臨床試驗中,有本品組患者出現新生或復發惡性腫瘤的報告。淋巴瘤的發生率高於正常人群的預期值。雖然對照組的發生率低於正常人群的預期值,但是本品組觀察到的非-淋巴瘤的惡性腫瘤與正常人群的預期值相似。在一項探索性臨床試驗中,納入了吸菸或已戒菸的中重度慢性阻塞性肺病(COPD)患者,本品組發生惡性腫瘤的病例報告多於對照組。尚未知TNF抑制劑對惡性腫瘤發生的潛在作用。
抗核抗體(ANA)/抗雙鏈脫氧核糖核酸(dsDNA)抗體
臨床試驗中,基線時ANA陰性的本品組患者約有一半在治療中ANA呈陽性,此現象在安慰劑組患者中的發生率約為20%。在本品組患者中抗dsDNA抗體的轉陽率約為17%,而在安慰劑組患者中為0%。少見狼瘡及狼瘡樣綜合徵的報告。
充血性心力衰竭
在一項評價本品對中重度心力衰竭(紐約心臟學會Ⅲ/Ⅳ級且左心室射血分數≤35%)的Ⅱ期臨床研究中,將150名患者隨機分為3組:10mg/kg本品組51名、5mg/kg本品組50名、安慰劑組49名,每組接受3次輸液治療,可觀察到10mg/kg本品組因心力衰竭加重而死亡和住院的發生率較高。在第28周時,10mg/kg本品組有3例患者死亡,5mg/kg本品組有1例患者死亡,安慰劑組無死亡。在同一時間點時,因心力衰竭加重而住院的病例數,10mg/kg本品組有11例,5mg/kg本品組有3例,安慰劑組有5例。在隨訪的第1年死亡的病例數,10mg/kg本品組有8例,5mg/kg本品組和安慰劑組各有4例。尚未研究本品對輕度心力衰竭(紐約心臟學會Ⅰ/Ⅱ級)的影響。上市後經驗顯示,使用本品的患者(無論有無明顯誘發因素)有心力衰竭加重的報告。
罕見初發性心力衰竭(包括無已知既往心血管疾病的患者出現的心力衰竭)報告,其中一些患者的年齡在50歲以下。
青少年類風濕關節炎
在一項14周的多中心、隨機、雙盲、安慰劑對照及其後最長至第44周的雙盲、全活性藥物延長治療試驗中評價了本品的安全性和有效性。共有122名年齡在4-17歲之間的活動性青少年類風濕關節炎患者入組,他們都曾使用了至少3個月的甲氨蝶呤,其中有120名患者接受了研究藥物的治療。同時允許其服用葉酸、口服皮質激素(≤10 mg/天)、非甾體類抗炎藥和/或甲氨蝶呤。
第0、2、6、14、20周靜脈輸注3 mg/kg的本品或安慰劑,隨後每隔8周給藥1次至第44周。為保持盲法治療,3 mg/kg劑量組的患者還在第16周接受了一次單劑量的安慰劑,隨機分入安慰劑組的患者在第14、16、20周交叉接受了6 mg/kg的本品,每隔8周給藥一次至第44周。本品用於青少年類風濕關節炎患兒的有效性和安全性尚未確定。接受本品3 mg/kg合用甲氨蝶呤的60名青少年類風濕關節炎患兒中有41名(68.3%)在觀察52周后發生了感染,接受本品6 mg/kg合用甲氨蝶呤的57名青少年類風濕關節炎患兒中有37名(64.9%)在觀察38周后發生了感染,接受安慰劑合用甲氨蝶呤的60名青少年類風濕關節炎患兒中有28名(46.7%)在觀察14周后出現感染。最常報告的感染是上呼吸道和咽炎,最常報告的嚴重感染是肺炎。其他值得關注的感染是1例原發性水痘和1例帶狀皰疹。接受本品3 mg/kg的青少年類風濕關節炎患兒輸液反應的發生率為35.0%,6 mg/kg組為17.5%。最常報告的輸液反應是噁心、發熱、頭痛和低血壓。本品3 mg/kg組中4人發生了嚴重輸液反應,3人報告出現了可能的過敏性反應(其中2人是發生嚴重輸液反應者)。本品6 mg/kg組中有2人發生嚴重輸液反應,其中1人出現可能的過敏性反應。出現嚴重輸液反應的6人中有2人快速輸注(輸注時間少於2小時)了本品。3 mg/kg組有37.7%的青少年類風濕關節炎患兒出現了本品的抗體,6 mg/kg組為12.2%。而且3 mg/kg組的抗體效價明顯高於6 mg/kg組。
兒童克羅恩病
一般而言,接受本品的克羅恩病患兒出現不良事件的頻率和種類與成年克羅恩患者相似。下文中討論了區別於成人的不良事件及其他需考慮的特殊事項。
與385名接受相似療法的成年克羅恩病患者相比,更常報告於103名接受本品5 mg/kg治療54周的克羅恩病患兒中的不良事件包括 :貧血(10.7%)、血便(9.7%)、白細胞減少(8.7%)、潮紅(8.7%)、病毒性感染(7.8%)、中性粒細胞減少症(6.8%)、骨折(6.8%)、細菌性感染(5.8%)、呼吸道過敏反應(5.8%)。
在REACH試驗中56.3%的患者和ACCENT1試驗中5 mg/kg本品組50.3%的患者出現了感染。在REACH試驗中,每隔8周給藥患者的感染髮生率高於每隔12周組(分別為73.6%和38.0%),但是3名每隔8周給藥的患者和4名每隔12周給藥的患者出現了嚴重感染。最常報告的感染是上呼吸道感染和咽炎,最常報告的嚴重感染是膿腫。3名患者報告感染了肺炎,其中2名是每隔8周維持給藥的患者,1名是每隔12周維持給藥的患者。每隔8周維持治療組報告有2例患者發生了帶狀皰疹。總之,REACH試驗中17.5%的患者至少出現了1次輸液反應,其中每隔8周維持給藥組為17.0%,每隔12周組為18.0%。但是未出現嚴重的輸液反應,僅有2名患者出現了非嚴重性過敏反應。3名(2.9%)克羅恩病患兒出現了本品的抗體。
上市後用藥經驗
本品在全球範圍內上市後用藥經驗中報告的其他不良事件(某些可能導致死亡)列於下表。由於這些事件均來源於自發性報告,總體用藥人數不詳,因此不能明確判斷其發生率或確定與本品的相關性。
上市後最常見報告自兒童的嚴重不良事件是感染(某些可導致死亡),包括條件致病菌的感染和結核病、輸液反應和過敏性反應。上市後兒童的嚴重不良事件自發報告還包括惡性腫瘤、一過性肝酶異常、狼瘡樣綜合徵和自身抗體陽性。
罕見接受本品治療的克羅恩病青少年患者出現肝脾T細胞淋巴瘤。



禁忌
·已知對鼠源蛋白或本品其它成份過敏的患者禁用。
·對於患有中重度心力衰竭(紐約心臟學會Ⅲ/Ⅳ級)的患者,給予本品10mg/ml可能增加因心力衰竭加重引起的住院率和死亡率。因此本品劑量高於5mg/ml,時禁用於中重度心力衰竭患者。
·對於患有中重度心力衰竭(紐約心臟學會Ⅲ/Ⅳ級)的患者,給予本品10mg/ml可能增加因心力衰竭加重引起的住院率和死亡率。因此本品劑量高於5mg/ml,時禁用於中重度心力衰竭患者。
注意事項
感染
在接受本品治療的患者中曾觀察到有細菌性感染(包括敗血症和肺炎)、分枝桿菌感染 [包括結核病(臨床多表現為血行播散性肺結核或肺外結核)]、侵襲性真菌感染、病毒感染和其它其他機會性感染,其中某些感染可能導致死亡。
在使用本品治療前,應評估患者是否有感染結核病的危險因素(包括與活動性結核病患者密切接觸),並應檢查患者是否有潛伏性結核感染。結核菌素試驗可能出現假陰性結果,尤其是重症或免疫低下的患者。
在使用本品之前,應對有潛伏性結核病菌感染的患者進行治療。
在使用本品治療前,應考慮對有潛伏性或活動性結核病既往病史且不能確定已接受足夠治療療程的患者進行抗結核病治療。
在使用本品治療前,還應考慮對潛伏性結核病試驗結果呈陰性但具有多種或高度結核病感染危險因素的患者進行抗結核病治療。
僅在諮詢結核病治療專科醫生並充分考慮潛在的結核感染風險和抗結核病治療風險後,方可做出對上述患者開始抗結核病治療的決定。
在接受本品治療的過程中及結束後,應對患者(包括潛伏性結核感染試驗結果陰性的患者)密切監測活動性結核病的體徵和症狀。
本品不套用於嚴重感染活動期的患者。伴有慢性感染或有反覆感染病史的患者應慎用本品。應告知患者並使其儘可能避免處於可能引起感染的潛在危險因素中。
充血性心力衰竭
對於患有中重度心力衰竭(紐約心臟學會III/IV級)的患者,未發現給予本品5 mg/kg會增加因心力衰竭加重引起的住院率和死亡率。但是在5 mg/kg或以下劑量或對輕度心力衰竭(紐約心臟學會I/II級)患者,尤其在長期治療中,不能排除不良反應的發生。因此,對心力衰竭患者,應在考慮其他治療方法後,才能慎重使用本品,且劑量不應超過5 mg/kg。如果決定給心力衰竭患者使用本品,應在治療過程中對其進行嚴密觀察。一旦心力衰竭的症狀加重或出現新的心力衰竭症狀,則應停用本品。
輸液反應/過敏反應
本品的過敏反應可在不同的時間內發生,多數出現在輸液過程中或輸液後2小時內,症狀包括蕁麻疹、呼吸困難和/或支氣管痙攣(罕見)、喉頭水腫、咽部水腫和低血壓。使用本品1-14天后,個別克羅恩病患者出現血清病樣反應,症狀包括發熱、皮疹、頭痛、咽喉痛、肌肉痛、多關節痛、手及面部浮腫和/或吞咽困難。如發生過敏反應,應立即採取治療措施。發生嚴重反應時,應停止使用本品。
ATTRACT試驗資料顯示,一些預防性措施(使用對乙醯氨基酚和/或抗組胺藥物)可減少輸液反應的發生。為減少輸液反應的發生,尤其對以前出現過輸液反應的患者,應將輸液速度放慢。
自身免疫
使用本品治療可能會促使自身抗體的形成,罕見狼瘡樣綜合徵。若患者在接受本品治療時出現狼瘡樣綜合徵徵兆,則應立即停藥。
神經系統
罕見本品及其他TNFα抑制劑與包括多發性硬化症在內的中樞神經系統脫髓鞘疾病(經臨床症狀新發或加重和/或放射學檢查證實)有關的病例。罕見視神經炎和癲癇發作的病例,可能與本品的使用有關。對於曾患有或新近患有中樞神經系統脫髓鞘疾病的患者,應在給予本品前權衡利弊。
肝膽系統
在本品上市後經驗中觀察到非常罕見的黃疸和非傳染性肝炎(其中一些具有自身免疫性肝炎的特徵)的病例,還出現個別導致肝移植或死亡的肝衰竭病例。應對有肝功能障礙體徵和症狀的患者評價其肝臟損傷的情況。如患者的黃疸指數和/或谷丙轉氨酶升高至正常範圍上限的5倍以上,應停止使用本品,並針對異常情況進行全面檢查。與使用其它免疫抑制劑觀察到的一樣,使用本品的B肝病毒慢性攜帶者(即表面抗原陽性者)有出現B型肝炎再活化的情況。在開始使用本品前和使用本品治療的過程中,應對B肝病毒慢性攜帶者進行適當的評價和觀察。
惡性腫瘤
淋巴瘤
所有TNF抑制劑的臨床對照試驗中,TNF抑制劑組觀察到的淋巴瘤發生病例高於對照組。在類風濕關節炎、克羅恩病、銀屑病型關節炎、強直性脊柱炎和潰瘍性結腸炎患者使用本品的臨床試驗中,本品治療組淋巴瘤的發生率高於普通人群的預期值,但是罕見發生淋巴瘤。克羅恩病或類風濕關節炎患者,尤其是疾病處於高活動性和/或長期處於免疫抑制劑的治療下時,即使未使用TNF 抑制劑其發生淋巴瘤的風險也高於正常人(達幾倍)。
肝脾T細胞淋巴瘤
在本品上市後的經驗中,罕見青少年克羅恩病患者發生肝脾T細胞淋巴瘤的報告。這種罕見的T細胞淋巴瘤具有很強的侵襲性,而且通常會導致死亡。上述所有出現肝脾T細胞淋巴瘤的患者都合用了硫唑嘌呤或6-巰基嘌呤,而且未使用本品經6-巰基嘌呤治療的克羅恩病患者也有發生肝脾T細胞淋巴瘤的病例。本品與發生T細胞淋巴瘤的相關性尚不明確。
非-淋巴瘤的惡性腫瘤
在一些TNF 抑制劑的臨床對照試驗中,觀察到TNF 抑制劑組出現非-淋巴瘤的惡性腫瘤的病例高於對照組。本品組非-淋巴瘤惡性腫瘤的發生率與普通人群的預期值相似,而對照組的發生率低於預期值。
在一項探索性中重度慢性阻塞性肺病(COPD)患者使用本品的臨床試驗評價中,本品組報告發生惡性腫瘤的病例多於對照組。上述患者均有嚴重吸菸史。
尚未知TNF抑制劑對惡性腫瘤發生的潛在作用。有惡性腫瘤病史的患者接受治療或發生惡性腫瘤的患者繼續治療時,應慎用本品。
TNFα抑制劑與阿那白滯素合用
在阿那白滯素與TNFα抑制劑依那西普合用的臨床研究中,曾觀察到嚴重感染的病例,與單獨使用依那西普相比,療效並未加強。根據阿那白滯素與依那西普合用發現的不良事件的性質,可推測出阿那白滯素與其它TNFα抑制劑合用可能產生類似的不良反應。因此,不建議本品與阿那白滯素合併使用。
疫苗接種
無資料顯示接受TNF抑制劑治療的患者在接種活疫苗後出現接種反應或被感染,但不建議本品與活疫苗同時使用。在ASPIRE研究中,每個治療組中多價肺炎球菌疫苗的藥物濃度增加2倍的患者比例相當,顯示出本品不干擾T細胞依賴的體液免疫應答。
如可能,推薦兒童克羅恩病患兒在按照疫苗接種指導原則接種完所有疫苗後再開始使用本品。
請置於兒童不易拿到處。
在接受本品治療的患者中曾觀察到有細菌性感染(包括敗血症和肺炎)、分枝桿菌感染 [包括結核病(臨床多表現為血行播散性肺結核或肺外結核)]、侵襲性真菌感染、病毒感染和其它其他機會性感染,其中某些感染可能導致死亡。
在使用本品治療前,應評估患者是否有感染結核病的危險因素(包括與活動性結核病患者密切接觸),並應檢查患者是否有潛伏性結核感染。結核菌素試驗可能出現假陰性結果,尤其是重症或免疫低下的患者。
在使用本品之前,應對有潛伏性結核病菌感染的患者進行治療。
在使用本品治療前,應考慮對有潛伏性或活動性結核病既往病史且不能確定已接受足夠治療療程的患者進行抗結核病治療。
在使用本品治療前,還應考慮對潛伏性結核病試驗結果呈陰性但具有多種或高度結核病感染危險因素的患者進行抗結核病治療。
僅在諮詢結核病治療專科醫生並充分考慮潛在的結核感染風險和抗結核病治療風險後,方可做出對上述患者開始抗結核病治療的決定。
在接受本品治療的過程中及結束後,應對患者(包括潛伏性結核感染試驗結果陰性的患者)密切監測活動性結核病的體徵和症狀。
本品不套用於嚴重感染活動期的患者。伴有慢性感染或有反覆感染病史的患者應慎用本品。應告知患者並使其儘可能避免處於可能引起感染的潛在危險因素中。
充血性心力衰竭
對於患有中重度心力衰竭(紐約心臟學會III/IV級)的患者,未發現給予本品5 mg/kg會增加因心力衰竭加重引起的住院率和死亡率。但是在5 mg/kg或以下劑量或對輕度心力衰竭(紐約心臟學會I/II級)患者,尤其在長期治療中,不能排除不良反應的發生。因此,對心力衰竭患者,應在考慮其他治療方法後,才能慎重使用本品,且劑量不應超過5 mg/kg。如果決定給心力衰竭患者使用本品,應在治療過程中對其進行嚴密觀察。一旦心力衰竭的症狀加重或出現新的心力衰竭症狀,則應停用本品。
輸液反應/過敏反應
本品的過敏反應可在不同的時間內發生,多數出現在輸液過程中或輸液後2小時內,症狀包括蕁麻疹、呼吸困難和/或支氣管痙攣(罕見)、喉頭水腫、咽部水腫和低血壓。使用本品1-14天后,個別克羅恩病患者出現血清病樣反應,症狀包括發熱、皮疹、頭痛、咽喉痛、肌肉痛、多關節痛、手及面部浮腫和/或吞咽困難。如發生過敏反應,應立即採取治療措施。發生嚴重反應時,應停止使用本品。
ATTRACT試驗資料顯示,一些預防性措施(使用對乙醯氨基酚和/或抗組胺藥物)可減少輸液反應的發生。為減少輸液反應的發生,尤其對以前出現過輸液反應的患者,應將輸液速度放慢。
自身免疫
使用本品治療可能會促使自身抗體的形成,罕見狼瘡樣綜合徵。若患者在接受本品治療時出現狼瘡樣綜合徵徵兆,則應立即停藥。
神經系統
罕見本品及其他TNFα抑制劑與包括多發性硬化症在內的中樞神經系統脫髓鞘疾病(經臨床症狀新發或加重和/或放射學檢查證實)有關的病例。罕見視神經炎和癲癇發作的病例,可能與本品的使用有關。對於曾患有或新近患有中樞神經系統脫髓鞘疾病的患者,應在給予本品前權衡利弊。
肝膽系統
在本品上市後經驗中觀察到非常罕見的黃疸和非傳染性肝炎(其中一些具有自身免疫性肝炎的特徵)的病例,還出現個別導致肝移植或死亡的肝衰竭病例。應對有肝功能障礙體徵和症狀的患者評價其肝臟損傷的情況。如患者的黃疸指數和/或谷丙轉氨酶升高至正常範圍上限的5倍以上,應停止使用本品,並針對異常情況進行全面檢查。與使用其它免疫抑制劑觀察到的一樣,使用本品的B肝病毒慢性攜帶者(即表面抗原陽性者)有出現B型肝炎再活化的情況。在開始使用本品前和使用本品治療的過程中,應對B肝病毒慢性攜帶者進行適當的評價和觀察。
惡性腫瘤
淋巴瘤
所有TNF抑制劑的臨床對照試驗中,TNF抑制劑組觀察到的淋巴瘤發生病例高於對照組。在類風濕關節炎、克羅恩病、銀屑病型關節炎、強直性脊柱炎和潰瘍性結腸炎患者使用本品的臨床試驗中,本品治療組淋巴瘤的發生率高於普通人群的預期值,但是罕見發生淋巴瘤。克羅恩病或類風濕關節炎患者,尤其是疾病處於高活動性和/或長期處於免疫抑制劑的治療下時,即使未使用TNF 抑制劑其發生淋巴瘤的風險也高於正常人(達幾倍)。
肝脾T細胞淋巴瘤
在本品上市後的經驗中,罕見青少年克羅恩病患者發生肝脾T細胞淋巴瘤的報告。這種罕見的T細胞淋巴瘤具有很強的侵襲性,而且通常會導致死亡。上述所有出現肝脾T細胞淋巴瘤的患者都合用了硫唑嘌呤或6-巰基嘌呤,而且未使用本品經6-巰基嘌呤治療的克羅恩病患者也有發生肝脾T細胞淋巴瘤的病例。本品與發生T細胞淋巴瘤的相關性尚不明確。
非-淋巴瘤的惡性腫瘤
在一些TNF 抑制劑的臨床對照試驗中,觀察到TNF 抑制劑組出現非-淋巴瘤的惡性腫瘤的病例高於對照組。本品組非-淋巴瘤惡性腫瘤的發生率與普通人群的預期值相似,而對照組的發生率低於預期值。
在一項探索性中重度慢性阻塞性肺病(COPD)患者使用本品的臨床試驗評價中,本品組報告發生惡性腫瘤的病例多於對照組。上述患者均有嚴重吸菸史。
尚未知TNF抑制劑對惡性腫瘤發生的潛在作用。有惡性腫瘤病史的患者接受治療或發生惡性腫瘤的患者繼續治療時,應慎用本品。
TNFα抑制劑與阿那白滯素合用
在阿那白滯素與TNFα抑制劑依那西普合用的臨床研究中,曾觀察到嚴重感染的病例,與單獨使用依那西普相比,療效並未加強。根據阿那白滯素與依那西普合用發現的不良事件的性質,可推測出阿那白滯素與其它TNFα抑制劑合用可能產生類似的不良反應。因此,不建議本品與阿那白滯素合併使用。
疫苗接種
無資料顯示接受TNF抑制劑治療的患者在接種活疫苗後出現接種反應或被感染,但不建議本品與活疫苗同時使用。在ASPIRE研究中,每個治療組中多價肺炎球菌疫苗的藥物濃度增加2倍的患者比例相當,顯示出本品不干擾T細胞依賴的體液免疫應答。
如可能,推薦兒童克羅恩病患兒在按照疫苗接種指導原則接種完所有疫苗後再開始使用本品。
請置於兒童不易拿到處。
孕婦及哺乳期婦女用藥
孕婦
由於本品與除人類和黑猩猩以外種屬的TNFα(無交叉反應,因此未進行本品在動物體內的生殖研究。對小鼠使用選擇性抑制小鼠TNFα功能活性的類似抗體進行了生育和一般生殖毒性試驗,未發現該抗體有母體毒性、胚胎毒性和致畸性。對藥效學動物模型使用劑量為10-15mg/kg的類似抗TNF抗體,可產生最大的藥理活性。在動物生殖毒性研究中,劑量達40mg/kg時,未產生不良影響。尚不知本品是否會對胎兒造成危害或影響生育能力。對孕婦,只有在確實需要時,方可給予本品。
哺乳期
尚不知本品是否經母乳排出以及食入後是否全身吸收。由於許多藥物和免疫球蛋白可經母乳排出,又因本品對嬰幼兒的潛在不良反應,因此應考慮本品對母親的重要性來決定是否停止哺乳或停止用藥。
由於本品與除人類和黑猩猩以外種屬的TNFα(無交叉反應,因此未進行本品在動物體內的生殖研究。對小鼠使用選擇性抑制小鼠TNFα功能活性的類似抗體進行了生育和一般生殖毒性試驗,未發現該抗體有母體毒性、胚胎毒性和致畸性。對藥效學動物模型使用劑量為10-15mg/kg的類似抗TNF抗體,可產生最大的藥理活性。在動物生殖毒性研究中,劑量達40mg/kg時,未產生不良影響。尚不知本品是否會對胎兒造成危害或影響生育能力。對孕婦,只有在確實需要時,方可給予本品。
哺乳期
尚不知本品是否經母乳排出以及食入後是否全身吸收。由於許多藥物和免疫球蛋白可經母乳排出,又因本品對嬰幼兒的潛在不良反應,因此應考慮本品對母親的重要性來決定是否停止哺乳或停止用藥。
兒童用藥
本品用於4歲以下的青少年類風濕關節炎患者和6歲以下的克羅恩病患兒的研究尚未進行。
對於青少年類風濕關節炎和強直性脊柱炎患者,使用本品的安全性和有效性尚未確定。
本品用於克羅恩病患兒的藥代動力學特性見[藥代動力學]。
對於青少年類風濕關節炎和強直性脊柱炎患者,使用本品的安全性和有效性尚未確定。
本品用於克羅恩病患兒的藥代動力學特性見[藥代動力學]。
老年用藥
尚未進行對老年患者使用本品的特定研究。尚未觀察到本品的體內分布容積和清除率與年齡的相關性,但由於通常老年人群的感染髮病率較高,因此在治療老年患者時應慎重使用。
藥物相互作用
尚未進行特定的藥物相互作用研究。
依那西普(TNFα抑制劑)與阿那白滯素(白介素-1自抗劑)合用時可能增加嚴重感染、嗜中性粒細胞減少症的風險,且相對於單獨用藥,此類合併用藥並無臨床優勢。阿那白滯素與其它TNFα抑制劑(包括本品)合用可能產生類似的不良反應。
依那西普(TNFα抑制劑)與阿那白滯素(白介素-1自抗劑)合用時可能增加嚴重感染、嗜中性粒細胞減少症的風險,且相對於單獨用藥,此類合併用藥並無臨床優勢。阿那白滯素與其它TNFα抑制劑(包括本品)合用可能產生類似的不良反應。
藥物過量
單次給藥劑量達到20mg/kg時未出現直接毒性反應。
藥理毒理
藥理作用
本品為人-鼠嵌合性單克隆抗體,可與TNFα的可溶形式和透膜形式以高親和力結合,抑制TNFα與受體結合,從而使TNF失去物活性。TNFβ(淋巴毒素α)是一種與TNFα利用相同受體的細胞因子,但本品並不抑制TNFβ的活性。TNFα的生物活性包括 :致炎細胞因子,如白介素-1和白介素-6(IL) ;增加內皮層通透性和內皮細胞及白細胞表達粘附分子以增強白細胞遷移 ;活化嗜中性粒細胞和嗜酸性粒細胞的功能活性 ;誘生急性期反應物和其他肝臟蛋白質以及誘導滑膜細胞和/或軟骨細胞產生組織降解酶。在體外和體內試驗中,表達透膜TNFα的細胞與本品結合後可被溶解。在利用人體纖維母細胞、內皮細胞、嗜中性粒細胞、B淋巴細胞、T淋巴細胞和上皮細胞進行的多項體外生物檢測中,本品均可抑制TNFα的功能活性。抗TNFα的抗體可降低小絹猴結腸炎模型的疾病活動性。在用鼠類膠原誘導性關節炎模型進行的試驗中,抗TNFα抗體還可減輕滑膜炎和關節侵蝕。對由人體TNFα表達所致的多關節炎的轉基因小鼠,本品可預防該疾病的發生,且對已患病的小鼠,在給藥後可使被炎症侵蝕的關節恢復。在體內試驗中,本品可與人體TNFα迅速形成穩定複合物,從而使TNFα失去生物活性。
在類風濕關節炎、克羅恩病和強直性脊柱炎患者的相關組織和體液中可測出高濃度的TNFα。對於類風濕關節炎,本品可減少炎性細胞向關節炎症部位的浸潤 ;減少介導細胞粘附的分子[內皮細胞選擇素、細胞間粘附分子-1(ICAM-1)和血管細胞粘附分子-1(VCAM-1)]的表達 ;減少化學誘導作用[白介素8(IL-8)和單核細胞趨化蛋白(MCP-1)]及組織降解作用[基質金屬白酶(MMP)1和3]。克羅恩病和類風濕關節炎患者經本品治療後,血清中白介素-6(IL-6)和C-反應蛋白(CRP)的水平降低。經本品治療的患者,其外周血液淋巴細胞在數量上或對促有絲分裂作用的增生反應(體外試驗)上,較未接受治療的患者並無顯著降低。經本品治療的銀屑病型關節炎患者中,其T細胞和滑膜內血管的數量下降,銀屑病皮膚病變和滑膜內巨噬細胞的數量下降。
首次給藥後,在基線期、第3天、第10周時,對損傷皮膚進行的活組織檢查表明本品會改變斑塊型銀屑病組織病理學特徵。本品能降低皮膚厚度和炎症細胞的滲入,下調淋巴細胞抗原(CLA)陽性的表皮活化炎症細胞的表達,包括CD3-、CD4-、CD8-陽性的淋巴細胞,下調CD1陽性的表皮黑素細胞的表達。
對使用本品4周后結腸的組織學研究顯示了TNFα檢出濃度較使用前有顯著降低。克羅恩病患者使用本品治療後,也可觀察到炎症反應標記物C-反應蛋白(CRP)血清濃度的顯著降低。使用本品後,患者體內的淋巴細胞、單核細胞和嗜中性粒細胞數量趨向正常,對外周血白細胞總數的影響極小。相對未使用本品治療的患者,使用本品治療後,患者體內的外周血單核細胞(PBMC)因刺激而增生的反應並未減少,且應激後的PBMC在產生細胞因子方面無顯著變化。對腸黏膜固有層的活體組織分析顯示本品可減少能表達TNFα和γ-干擾素的單核細胞數量。其他組織學研究表明本品可減少炎性細胞向腸內病變部位的浸潤以及這些部位炎症標記物的量。
對使用本品的中重度活性潰瘍性結腸炎患者,在給藥前、第8、30周進行的結腸活組織檢查表明本品可促使組織學上的黏膜癒合和粘蛋白表達下降。粘蛋白是組織損害的標誌。使用本品治療8周后炎症因子HLA-DR、CD3+淋巴細胞和中性粒細胞聯合明膠酶B、髓過氧化酶水平下調。
首次使用本品治療後最初的2周內,中重度潰瘍性結腸炎患者的血清致炎細胞因子IL-2R、IL-6、IL-8和ICAM水平降低了。這種作用會普遍存在於首次使用本品治療後的第8-30周。
毒理研究
- 遺傳毒性:
在小鼠體內微核試驗或沙門菌-大腸埃希菌突變(艾姆斯)試驗中,未發現本品有致突變性。在利用人體淋巴細胞進行的試驗中,也未觀察到染色體畸變。尚不知這些發現對人體的意義。
- 生殖毒性:
cV1q是一種與本品類似的抗體,可以抑制小鼠體內TNFα的活性。採用cV1q進行的生殖毒性研究中,未觀察到其對動物生殖能力的影響。
- 致癌性:
利用接受cV1q抗小鼠TNF抗體的小鼠進行的一項重複劑量毒理學研究對該抗體的致癌性進行了評價。試驗中,將小鼠分為3組,每周分別接受對照品、cV1q 10 mg/kg或cV1q 40 mg/kg,持續6個月。每周10 mg/kg和 40 mg/kg的小鼠劑量分別為克羅恩病患者用藥劑量(5 mg/kg)的2倍和8倍。結果顯示cV1q對小鼠未產生致癌性。
本品為人-鼠嵌合性單克隆抗體,可與TNFα的可溶形式和透膜形式以高親和力結合,抑制TNFα與受體結合,從而使TNF失去物活性。TNFβ(淋巴毒素α)是一種與TNFα利用相同受體的細胞因子,但本品並不抑制TNFβ的活性。TNFα的生物活性包括 :致炎細胞因子,如白介素-1和白介素-6(IL) ;增加內皮層通透性和內皮細胞及白細胞表達粘附分子以增強白細胞遷移 ;活化嗜中性粒細胞和嗜酸性粒細胞的功能活性 ;誘生急性期反應物和其他肝臟蛋白質以及誘導滑膜細胞和/或軟骨細胞產生組織降解酶。在體外和體內試驗中,表達透膜TNFα的細胞與本品結合後可被溶解。在利用人體纖維母細胞、內皮細胞、嗜中性粒細胞、B淋巴細胞、T淋巴細胞和上皮細胞進行的多項體外生物檢測中,本品均可抑制TNFα的功能活性。抗TNFα的抗體可降低小絹猴結腸炎模型的疾病活動性。在用鼠類膠原誘導性關節炎模型進行的試驗中,抗TNFα抗體還可減輕滑膜炎和關節侵蝕。對由人體TNFα表達所致的多關節炎的轉基因小鼠,本品可預防該疾病的發生,且對已患病的小鼠,在給藥後可使被炎症侵蝕的關節恢復。在體內試驗中,本品可與人體TNFα迅速形成穩定複合物,從而使TNFα失去生物活性。
在類風濕關節炎、克羅恩病和強直性脊柱炎患者的相關組織和體液中可測出高濃度的TNFα。對於類風濕關節炎,本品可減少炎性細胞向關節炎症部位的浸潤 ;減少介導細胞粘附的分子[內皮細胞選擇素、細胞間粘附分子-1(ICAM-1)和血管細胞粘附分子-1(VCAM-1)]的表達 ;減少化學誘導作用[白介素8(IL-8)和單核細胞趨化蛋白(MCP-1)]及組織降解作用[基質金屬白酶(MMP)1和3]。克羅恩病和類風濕關節炎患者經本品治療後,血清中白介素-6(IL-6)和C-反應蛋白(CRP)的水平降低。經本品治療的患者,其外周血液淋巴細胞在數量上或對促有絲分裂作用的增生反應(體外試驗)上,較未接受治療的患者並無顯著降低。經本品治療的銀屑病型關節炎患者中,其T細胞和滑膜內血管的數量下降,銀屑病皮膚病變和滑膜內巨噬細胞的數量下降。
首次給藥後,在基線期、第3天、第10周時,對損傷皮膚進行的活組織檢查表明本品會改變斑塊型銀屑病組織病理學特徵。本品能降低皮膚厚度和炎症細胞的滲入,下調淋巴細胞抗原(CLA)陽性的表皮活化炎症細胞的表達,包括CD3-、CD4-、CD8-陽性的淋巴細胞,下調CD1陽性的表皮黑素細胞的表達。
對使用本品4周后結腸的組織學研究顯示了TNFα檢出濃度較使用前有顯著降低。克羅恩病患者使用本品治療後,也可觀察到炎症反應標記物C-反應蛋白(CRP)血清濃度的顯著降低。使用本品後,患者體內的淋巴細胞、單核細胞和嗜中性粒細胞數量趨向正常,對外周血白細胞總數的影響極小。相對未使用本品治療的患者,使用本品治療後,患者體內的外周血單核細胞(PBMC)因刺激而增生的反應並未減少,且應激後的PBMC在產生細胞因子方面無顯著變化。對腸黏膜固有層的活體組織分析顯示本品可減少能表達TNFα和γ-干擾素的單核細胞數量。其他組織學研究表明本品可減少炎性細胞向腸內病變部位的浸潤以及這些部位炎症標記物的量。
對使用本品的中重度活性潰瘍性結腸炎患者,在給藥前、第8、30周進行的結腸活組織檢查表明本品可促使組織學上的黏膜癒合和粘蛋白表達下降。粘蛋白是組織損害的標誌。使用本品治療8周后炎症因子HLA-DR、CD3+淋巴細胞和中性粒細胞聯合明膠酶B、髓過氧化酶水平下調。
首次使用本品治療後最初的2周內,中重度潰瘍性結腸炎患者的血清致炎細胞因子IL-2R、IL-6、IL-8和ICAM水平降低了。這種作用會普遍存在於首次使用本品治療後的第8-30周。
毒理研究
- 遺傳毒性:
在小鼠體內微核試驗或沙門菌-大腸埃希菌突變(艾姆斯)試驗中,未發現本品有致突變性。在利用人體淋巴細胞進行的試驗中,也未觀察到染色體畸變。尚不知這些發現對人體的意義。
- 生殖毒性:
cV1q是一種與本品類似的抗體,可以抑制小鼠體內TNFα的活性。採用cV1q進行的生殖毒性研究中,未觀察到其對動物生殖能力的影響。
- 致癌性:
利用接受cV1q抗小鼠TNF抗體的小鼠進行的一項重複劑量毒理學研究對該抗體的致癌性進行了評價。試驗中,將小鼠分為3組,每周分別接受對照品、cV1q 10 mg/kg或cV1q 40 mg/kg,持續6個月。每周10 mg/kg和 40 mg/kg的小鼠劑量分別為克羅恩病患者用藥劑量(5 mg/kg)的2倍和8倍。結果顯示cV1q對小鼠未產生致癌性。
藥代動力學
單次靜脈輸注本品3-20 mg/kg,最大血清藥物濃度與劑量呈線性關係。穩態時的分布容積與劑量無關,說明本品主要分布於血管腔隙內。類風濕關節炎治療劑量為3 -10 mg/kg和克羅恩病治療劑量為5 mg/kg時的藥動學結果中值顯示,本品半衰期為7.9-9.5天。
每次治療中,在本品首劑給藥後的第2和6周重複輸注,可以得到預期的藥-時曲線。繼續重複給藥,未出現全身性蓄積。未發現清除率和分布容積在年齡或體重分組中有明顯差異。
每次治療中,在本品首劑給藥後的第2和6周重複輸注,可以得到預期的藥-時曲線。繼續重複給藥,未出現全身性蓄積。未發現清除率和分布容積在年齡或體重分組中有明顯差異。
貯藏
2-8℃避光保存。
包裝
玻璃瓶裝,1瓶/盒。
有效期
36個月
執行標準
JS20060017
生產企業
Cilag AG
核准日期
2007年02月15日
修訂日期
2007年11月27日 2007年12月26日 2008年03月07日 2008年10月13日
