功能
非洲馬瘟病毒引起的
非洲馬瘟是馬屬動物的一種急性或亞急性蟲媒傳染病,在非洲撒哈拉沙漠以南是地方性流行病. 傳播媒介是庫蠓的某些種類,其中最重要的是擬蚊庫蠓(Culioides.Imicola)。
非洲馬瘟是由病毒引起的單蹄獸的急性或亞急性傳染病。馬對本病易感性很高。病死率達95%。中國尚無此病。
本病主要流行於非洲大陸中部熱帶地區,並傳播到南部非洲,有時也傳播到北部非洲。近東與中東(1959)、
西班牙(1966,1987—1990)、
葡萄牙(1989)等非洲以外的國家也曾流行。中國尚無本病發生。
尚比亞發生非洲馬瘟2004年5月7日,尚比亞農業食品漁業部向OIE緊急報告,5月7日,中央省Chisamba地區發生1起非洲馬瘟,涉及有48匹馬,其中8匹馬發病並死亡。發病馬駒大多為7月齡,從未接種過非洲馬瘟疫苗。傳染來源不清楚。尚比亞上一次向OIE報告非洲馬瘟爆發的時間是1991年。
2004年5月31日,
波札那農業部向OIE緊急報告,4月15日,東南區哈博羅內地區發生了1起非洲馬瘟。涉及有30匹馬,1隻發病、死亡。估計最初感染的時間為2004年4月1日。診斷為非洲馬瘟。傳染來源不詳。非洲馬瘟在波札那呈零星爆發,波札那採取控制節肢動物、隔離、國內移運限制、免疫的控制措施。波札那上一次向OIE報告非洲馬瘟爆發的時間為2003年8月。
病原學
非洲馬瘟病毒屬
呼腸孤病毒科環狀病毒屬。現已知有9個血清型,各型之間沒有互動免疫關係,不同型病毒的毒力強弱也不相同。 病毒在37℃下可存活37天,而50℃3小時、60℃15分鐘可被滅活。在pH6.0~10之間穩定,在pH3.0時迅速死亡。能被
乙醚及0.4%β-丙烯內脂滅活。0.1%
福馬林48小時,以及被
石炭酸和碘伏滅活。
 非洲馬瘟
非洲馬瘟流行病學
病毒的貯藏宿主,目前尚未研究清楚。馬、騾、驢、
斑馬是病毒的易感宿主。馬尤其幼齡馬易感性最高,騾、驢依次降低。
大象、野驢、
駱駝、狗因接觸感染的血及馬肉也偶可感染。
傳染源為病馬、帶毒馬及其血液、內臟、精液、尿、分泌物及所有脫落組織。馬的病毒血症期一般持續4~8天,長的可達18天;斑馬、驢病毒血症期可持續28天以上。 本病發生有明顯的季節性和地域性,多見於溫熱潮濕季節,常呈地方流行或暴發流行,傳播迅速;厚霜、地勢高燥、自然屏障等影響媒介昆蟲繁殖或運動的氣候、地理條件,將使本病顯著減少。
 非洲馬瘟
非洲馬瘟發病機理
帶毒昆蟲叮咬動物後,病毒進入體內。病毒主要在肺,脾和淋巴結中複製,病毒存在於馬的
血液,滲出液,組液等體液中,大部分是吸附著於紅細胞上。病毒的增殖導致特定組織器官或身體某些部位的血管滲透性增加,引起肺泡,胸膜下和肺間質水腫,有時也出現嚴重的胸腔積水。 該期主要引起變性變化。病毒由呼吸道進入機體,被吞噬細胞帶至其他部位,在脾、
法氏囊和
胸腺引起溶細胞性感染,3-6天達高峰。主要靶細胞為B細胞和某些激活的T細胞。早期感染的致壞死作用引起急性炎症反應,約在第7天出現暫時性
免疫抑制。最後胸腺萎縮。B細胞壞死感染引起T細胞激活的應答對發病機理有很重要的意義,因為這一過程提供了大量供轉化的靶細胞。轉化需要有4個條件:第一,對感染易感;第二,對病毒複製(潛伏感染)的內在或外在控制;第三,發生細胞分裂以整合病毒基因組;第四,表達病毒
腫瘤基因或激活細胞腫瘤基因。在CMI應答導致轉入潛伏感染時被感染的激活T細胞滿足上述條件。因此,甚至在早期在溶細胞感染期就有轉化細胞或至少是供轉化的靶細胞存在。免疫應答在MD的發病機理上起重要作用,而MD也引起嚴重的免疫抑制。免疫抑制可由MDV對淋巴細胞的溶細胞感染直接引起,也可由抑制細胞群體的作用間接引起,兩者都重要。
 非洲馬瘟
非洲馬瘟臨床症狀
潛伏期通常為7~14天,短的僅2天。中國《陸生動物衛生法典》規定,非洲馬瘟的感染期 為40天。
 非洲馬瘟
非洲馬瘟按病程長短、症狀和病變部位,一般分為肺型(急性型)、心型(亞急性型、水腫型)、肺心型、發熱型和神經型。
肺型:多見於本病流行暴發初期或新發病的地區。呈急性經過。病畜體溫升高達40~42℃,精神沉鬱、呼吸困難,心跳加快。眼結膜潮紅,羞明流淚。肺出現嚴重水腫,呼吸困難,並有劇烈咳嗽,鼻孔擴張,流出大量含泡沫樣液體。病程5~7天,常因窒息而死。
(1)肺型:呈急性經過多見於流行初期或新發生此病的地區。病馬體溫突然升高達41-42℃,持續1-2天降至常溫。病馬表現為結膜炎,呼吸迫促、脈搏加快。5-7天后死亡;(2)心型:為亞急性經過,病程緩慢。病馬體溫不超過40.5℃,持續10多天可見眼窩處發生水腫。其後消退或擴散到頭部、舌。有的蔓延至頸部、胸腹下甚至四肢。由於肺的水腫而引起心包炎、心肌炎、心內膜炎。伴有心臟衰弱的症狀。該型康復率較高;(3)肺心型:呈亞急性經過,多發生於有一定抵抗力的馬匹。具有肺型、心型的臨診症狀;(4)發熱型:此型℃多見於免疫或部分免疫的馬匹。該型潛伏期長,病程短。表現為病馬體溫升高到40℃,持續1-3天。病馬表現厭食,
結膜微紅,
脈搏呼吸增數。
該病的診斷必須經過實驗室檢查方能確診。可採集發熱期病馬血液或病死馬的脾臟進行病毒分離。同時還可採取發病初期及恢復期的馬
血清進行血清學診斷。
非洲馬瘟病死率變動幅度很大,最低為10%~25%,最高可達90%~95%,騾、驢病死率較低。耐過本病的馬匹只能對這同一型病毒的再感染有一定的免疫力。
 非洲馬瘟
非洲馬瘟病理變化
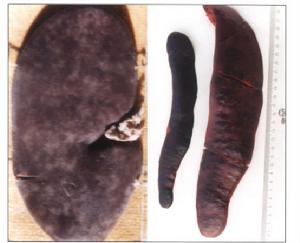
最特徵及最長劍的病變是皮下和肌肉間組織膠樣浸潤,並以眶上窩,眼和喉尤為顯著。 胃底黏膜卡他性腫脹一直延伸到小腸前部。咽,氣管,
支氣管充滿黃色漿液和泡沫,約有2/3病例有急性水腫。心內膜和心包膜有出血點和出血淤斑,心肌變性。有些病例胸腔和心包積存大量黃白色或紅色液體,淋巴結急性腫大,肝和胃充血。
 非洲馬瘟
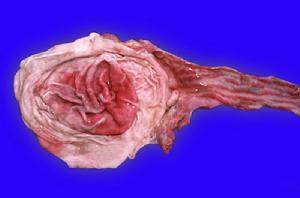
非洲馬瘟肺型病變為肺水腫;胸膜下、肺間質和胸淋巴結水腫,心包點狀淤血,胸腔積水。
心型病變為皮下和肌間組織膠腖樣水腫(常見於眼上窩、
眼瞼、頸部、肩部);
心包積液,心肌發炎,心內外膜點狀淤血;胃炎性出血。
診斷
根據臨床症狀和病理變化可做出初步診斷,確診需進一步做實驗室診斷。
普通診斷:(1)接種馬匹試驗:將病料製成1:10倍無菌懸液,接種健馬,每匹靜脈注射5毫升。一般4-10天體溫升至40-41℃,顯現非洲馬瘟症狀。(2)接種小白鼠試驗:將病料懸液接種2-4日齡乳鼠,每鼠腦仙接種0.01毫升,從第4天起可產生臨床症狀,出現中樞神經系統感染或衰竭死亡。(3)其他試驗:
補體結合試驗、
中和試驗、螢光抗體試驗、
瓊脂擴散試驗、
紅細胞凝集試驗等都可確診本病。實驗室診斷:在國際貿易中檢測的指定診斷方法有補體結合試驗、
酶聯免疫吸附試驗。替代診斷方法有
病毒中和試驗。
 非洲馬瘟
非洲馬瘟樣品採集:用於病原分離宜採集發熱期病畜全血,用OPG(50%甘油+O.5%草酸鈉+O.5%石炭酸)或肝素(按10IU/毫升添加)抗凝,於4℃下保存或送檢;或剛死亡動物的脾、肺和淋巴結(取2~4克小塊),置10%甘油緩衝液,於4℃下保存或送檢。
病毒分離:乳鼠接種、細胞接種(BHK、MS、Vero)、接種雞胚。
病毒鑑定:酶聯免疫吸附試驗(ELISA)、病毒中和試驗、聚合酶鏈反應(PCR)。
血清學診斷:酶聯免疫吸附試驗(ELISA)、補體結合試驗、
免疫印跡。
用於血清學診斷宜採集血清(最好采雙份血清,分別在急性期和康復期,或相隔21天採取,於-20℃下保存)。
生物學診斷
VP3蛋白的L3基因,VP7蛋白的S7基因,NS2蛋白的S8基因和NS3蛋白的S10基因都可作為模板用於RT-PCR的檢測。SailleauC等[16]利用VP2蛋白是AHSV的血清型特異性抗原,針對每一血清型的L2基因設計了9對引物,每對引物都是血清型特異性的,用它們可進行AHSV的鑑定和分型。經驗證,此方法是快速可靠的對AHSV進行鑑定和分型的方法,對AHS暴發早期時選擇疫苗和控制疾病傳播有重要作用。
核酸探針技術原理是鹼基配對。互補的兩條核酸單鏈通過退火形成雙鏈,這一過程稱為核酸雜交。核酸探針是指帶有標記物的已知序列的核酸片段,能和與其互補的核酸序列雜交,形成雙鏈,所以可用於待測核酸樣品中特定基因序列的檢測。每一種病原體都具有獨特的核酸片段,通過分離和標記這些片段就可製備出探針,用於疾病的診斷等研究。此方法具有特異性強、準確可靠的優點,關鍵是雜交靶鏈和探針的選擇。 此法主要套用於對不同毒株的分離和鑑定,因此靶序列最好是在AHSV血清群中有5%~10%的趨異,並能區分開其他環狀病毒的同源性序列。Brown等用NS1蛋白的L1基因作為靶鏈,用地高辛標記的RNA探針以原位雜交法鑑定AHSV,特異性好。Moulay等用VP7蛋白的S7基因cDNA作為靶鏈,用地高辛標記的探針以斑點印跡雜交法檢測AHSV,可作為病毒感染的常規和快速診斷方法。KoekemoerJJ等[17]根據VP2蛋白的L2基因設計了AHSV的型特異性探針用以對AHSV進行分型。用此法分型可在4d內完成,比傳統的病毒分離和分型方法所需時間的一半還要少。而MareeS等[10]設計一套通用引物擴增AHSV9個血清型L2基因5′端521bp~553bp,將它們作為血清型特異性探針與病毒L2基因的cDNA進行反向線點雜交。此法可準確對AHSV進行鑑定和分型,並可在1d內完成,可檢測到1pgdsRNA。
 非洲馬瘟
非洲馬瘟病毒詳解
AHSV的基本特性
該病毒無囊膜,直徑約75nm,有兩層20面體對稱的衣殼,由32個殼粒組成。基因組由
10個大小不等的雙鏈RNA片段構成,3個大的為L1~L3,3箇中等的為M4~M6,4個小的為S7~S10,編碼10個蛋白(VP1~VP7和NS1,NS2,NS3/NS3A)。內衣殼由2個主要蛋白VP3和VP7以及3個次要蛋白VP1、VP4和VP6構成,其中VP6被認為是病毒dsRNA的解旋酶[2]。外衣殼由2個蛋白VP2和VP5構成,當病毒通過細胞膜時會被脫掉。此外,至少還有3個非
結構蛋白(NS1,NS2和NS3/3A)存在於受感染的細胞中。 該病毒有9個抗原性不同的血清型[3]。雖然在野外沒有發現任何型內變異的證據,但通常認為血清型之間有某些交叉的親緣關係,尤其是在AHSV-1和2,AHSV-3和7,AHSV-5和8,以及AHSV-6和9之間。
AHSV的主要結構蛋白
2.1 VP2蛋白
VP2蛋白由L2基因編碼,是病毒最主要的型特異性抗原,與VP5一起能與病毒的中和抗體發生反應。AHSV9個血清型L2基因的cDNA有典型的環狀病毒5′-GTT和TAC-3′的末端序列。L2基因的ORF編碼蛋白的分子質量約為123ku。VP2蛋白序列在AHSV9個血清型中的變動範圍為47.6%~71.4%,是AHSV變異率最大的蛋白[4]。
BentleyL等[5]用噬菌體展示技術配合多種抗血清鑑定了重組AHSV-3VP2蛋白的多個抗原區域。大部分抗原位點和中和位點都在252aa~488aa區域。這個區域在病毒各血清型之間不僅差異大,而且大部分是親水性胺基酸,其中369aa~403aa之間有一個線性抗原表位[6]。此外,在有交叉反應的病毒血清型之間,這些抗原位點的內部序列有較高的一致性,因此,有交叉反應的血清型病毒之間有更高的同源性。這可解釋血清型之間的血清學
交叉反應。
AHSV-4VP2蛋白的主要抗原性區域位於199aa~414aa,而1aa~199aa(N端)和414aa~1060aa(C端)都無免疫原性[7]。AHSV-4VP2有15個抗原位點,分成兩組。一組覆蓋範圍223aa~400aa,包含12個抗原位點;另一組覆蓋範圍568aa~681aa,包含其他的3個
抗原位點。VP5和VP2相互作用,能更好地將VP2的中和表位展現出來,從而增強免疫反應。
15個位點中有3個可誘導產生AHSV-4的中和抗體,其中有2箇中和表位分別位於321aa~339aa和3
77aa~400aa[7]。這兩個表位聯合起來可誘導產生更有效的中和反應,但中和抗體滴度相對較低,不大可能用於生產AHSV的合成疫苗。此效果可能是由於抗體與一個表位結合後引起構象變化,使得其他抗體與另一表位的結合更容易;另一原因可能是此兩位點的中和反應在病毒感染中有不同的作用(如病毒與細胞的吸附,病毒的易位等)或它們構成了一個相對不連續表位的連續部分。ASHV-9VP2也有兩個中和表位[5]。同時,BTV在相同的區域也有中和表位,尤其是在328aa~335aa之間和327aa~402aa之間。因此,此區域可能是環狀病毒的一個主要抗原表位和重要的中和抗體靶位。這些表位可能在病毒衣殼的表面,因為中和表位通常結合在病毒表面以阻止病毒與細胞的受體結合而被細胞攝取。尤其是兩個中和表位在蛋白疏水性最強的區域,極有可能存在於病毒的表面。用ELISA檢測[7]這15個抗原位點,發現抗原位點8,11和12能與抗體結合,而抗原位點4,6和15雖然能與抗體發生反應,但它們不表現中和活性,尤其是位點4,它雖然在病毒表面,但不誘導產生中和抗體。其他位點不與抗體反應,說明它們可能埋入病毒
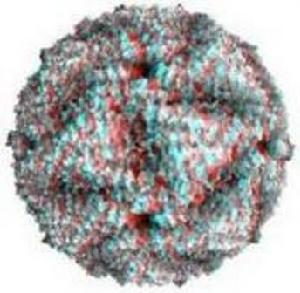 非洲馬瘟
非洲馬瘟非洲馬瘟病毒內部排列
表面或雖然暴露於病毒表面,以不被抗體識別的構象形式存在。
2.2 VP5蛋白
VP5蛋白由M6基因編碼。M6基因5′-端非編碼區的保守序列為5′-GUUAA-3′,此特點也體現在與AHSV相關的BTV和流行性出血熱病毒(epizootichaemorrhagicdiseasevirus,EHDV)中。而3′-端非編碼區的保守序列為5′-ACAUAC-3′,唯一的例外是AHSV-6,它的3′-端多一個
胞嘧啶核苷酸,為5′-ACAUACC-3′。M6基因的ORF編碼蛋白的分子質量約56.9ku。
AHSV-6,AHSV-4,BTV-10和EHDV-1的VP5胺基酸序列有較高的一致性[8]。3個保守區域位於N端(1aa~123aa),中部(192aa~273aa)和C端(438aa~491aa)。這些保守區域可能與VP2或VP7相互作用,從而保持病毒結構的穩定性。作為一個外殼蛋白,ASHV各血清型之間的VP5蛋白有很高的相似性,VP5被VP2蛋白包圍,不能與宿主發生中和反應。
VP5蛋白根據疏水性分布圖分為兩個部分[8],N端區域(1aa~220aa)和C端區域(約280aa~505aa),中間是一個丙氨酸-甘氨酸富集區(200aa~270aa)作為鉸鏈將兩部分連線。N端為螺旋狀,而C端是球形結構。這些區域在蛋白相互作用的分子內和分子間起穩定分子結構的作用。VP5的重要功能是與更保守的核心蛋白相互作用,以及補償VP2蛋白的變化。VP5能間接影響病毒的血清型,它與VP2相互作用,改變VP2的構象,從而引起病毒血清學特性的變化。
 非洲馬瘟
非洲馬瘟VP5在昆蟲細胞中單獨表達或與VP2共表達都能誘導產生AHSV特異性中和抗體[9]。VP5蛋白免疫顯性最明顯的區域在N端的330個殘基中,有兩個抗原區域,151aa~200aa和83aa~120aa,分為8個抗原位點,中和表位在85aa~92aa和179aa~185aa。前一個中和表位在不同的環狀病毒中高度保守,它的單克隆抗體能識別BTV和EHDV的VP5蛋白。
2.3 VP7蛋白和VP3蛋白
VP7蛋白和VP3蛋白分別由S7和L3基因編碼,是該病毒主要的內衣殼蛋白。VP7在ASHV各血清中高度保守,是該
非洲馬瘟抗原結構
病毒的血清群特異性抗原[10]。MareeS等[11]用重組桿狀病毒在昆蟲細胞中
克隆表達了ASHV-9的VP3和VP7,VP7表達水平高且聚集成獨特的晶體,VP3和VP7共表達可在細胞中形成類核心顆粒。AHSVVP7蛋白在感染細胞的胞漿中形成平面六邊形晶體,而由重組桿狀病毒表達的VP7則形成大的碟片狀晶體,在光鏡下可見。
在電鏡下觀察AHSV的VP3和VP7蛋白形成的類核心顆粒與ASHV空核心顆粒非常相似。與ASHV核心不同的是,類核心顆粒有一暗的中央區域,呈典型的20面體對稱結構。外層包圍著一低電子密度層,在形態上呈結節狀突起,並向外延伸,形成有絨毛外觀的類核心顆粒。AHSV類核心顆粒的直徑約為72nm,與BTV的類核心顆粒在冰凍時電鏡下的直徑一致,但比ASHV核心顆粒的直徑稍大。用VP7單克隆抗體與AHSV類核心顆粒反應,對它進行抗體修飾,電鏡下可見每個顆粒都被一層陰影包圍,那是VP7單克隆抗體與VP7外殼相互作用形成的。
Wade-Evans等研究了AHSV-9VP7作為亞單位疫苗的套用效果。以提純的AHSV-9VP7晶體免疫接種小鼠,用AHSV-7攻毒,發現VP7對小鼠的保護作用非常好。用變性的VP7晶體或細菌原核表達的GST-VP7融合蛋白接種所產生的保護作用比用VP7晶體接種所產生的保護作用要弱,說明VP7蛋白的構象對蛋白的功能有重要作用。而來自用AHSV-9VP7免疫的Balb/c小鼠的被動抗體不能保護新生同系小鼠不受AHSV-7的攻擊,這說明抗體可能不是唯一起保護作用的因素。
AHSV的非結構蛋白
該病毒有3個非結構蛋白,即NS1,NS2和NS3/NS3A。分別由M5,S8和S10基因編碼。
3.1 NS1蛋白
NS1在AHSV中高度保守。Huismans和Els於1979年就發現在環狀病毒感染的細胞胞漿中有獨特的病毒特異性微管
非洲馬瘟病毒重組過程
結構,它由NS1組成。在BTV感染的細胞中存在著大量此類微管,主要在胞核附近或周圍。這些形態結構黏附在細胞骨架的中間絲上。它們的作用可能是把成熟病毒粒子從病毒包涵體運到細胞膜,而後由NS3的作用將病毒釋放,或作為分子伴侶防止在次要蛋白(VP1,VP4和VP6)與病毒的基因組正確合併前組裝核心顆粒。
BTV和EHDV的NS1用重組桿狀病毒在昆蟲細胞中表達後都形成了微管。BTV的NS1微管直徑52.3nm,由NS1二聚體形成的螺旋組成,每個螺旋有22個NS1二聚體。Maree和Huismans用桿狀病毒在昆蟲細胞中表達AHSV-6NS1,並用蔗糖梯度密度離心沉降分析NS1微管,在200S~400S處收集到大量目的片段,說明表達的NS1蛋白以微粒或聚合體形式存在於感染細胞中。雖然NS1是這些片段最主要的蛋白成分,但也有數量不等的某些其他蛋白,推測為桿狀病毒的蛋白。
在200S~400S的NS1複合物中,微管的平均直徑為23nm±2nm,長度最長可達4μm。長度不等可能是由於提純過程中發生了斷裂,這也可能是NS1在蔗糖梯度中有不同沉降係數的原因。在電鏡下觀察,AHSV微管的精細結構與BTV和EHDV微管在外觀上很不相同。AHSV微管有一內部結構,呈細微的網狀交叉波紋狀。每個微管的中央區域有交替伸展的電子密度,而低密度區表示微管的空腔。微管的邊緣平滑,界線分明,無可見的亞單位結構。在更寬的BTV微管(68nm)和EHDV微管(52nn)中無梯狀或分節段的外觀。中空環狀結構可能表示微管的橫切面或大微管的非常短的小節段。這些結構的直徑與ASHV微管相符,其空腔直徑約為7nm。
在200S~400S片段中還有少量桿狀病毒的特異性微管。這些微管與AHSV微管明顯不同,它們更大(直徑40nm),且精細結構也不同。可用抗體鑑定AHSV微管。將微管固定在格線上,用ASHV-6抗血清與之結合。由於抗體與NS1結合,電鏡下觀察可見在NS1微管周圍有暗影,而桿狀病毒微管則無。
NS1微管在0.2mol/L和更高濃度的
CaCl2中不穩定,只能見到無定形的蛋白聚集物。在1mol/L的NaCl中,只能見到少量微管,它們的長度明顯減小,環狀形態非常多。在緩衝液中或pH8.0~8.5之間,微管形態也受到嚴重影響,長度減小,精細結構消失。NS1微管能耐受相對低的pH,但在鹼性條件下,它們比BTV微管更易降解。在pH5.0~5.5之間,微管的長度減小,而表面則變得不平滑。在pH5.0或更低時,微管變性,NS1聚集成無定形的蛋白聚集物。
3.2 NS3/NS3A蛋白
與NS1和NS2的高表達水平相比,兩個最小的非結構蛋白NS3和NS3A在感染細胞中合成量很少。這兩個相關的蛋 白由S10基因上兩個同相重疊的開放閱讀框編碼,兩者唯一的不同是NS3的N末端比NS3A多10個胺基酸。NS3存在於感染細胞的胞膜中,特別是在Vero細胞胞膜上的AHSV釋放位點,說明NS3與病毒的形態發生和釋放有關。病毒釋放可先於細胞病變效應或細胞溶解而發生。由重組桿狀病毒表達的AHSVNS3是膜相關蛋白,它的定位不依賴於AHSV顆粒的存在。此外,ASHVNS3用重組桿狀病毒表達時只合成24ku的NS3蛋白,不合成NS3A。
AHSVNS3的變異率在AHSV各蛋白中僅次於外衣殼蛋白VP2[12]。ASHV-8的NS3型間變異率達27.6%,而ASHV-4的NS3型間變異率只有15%。型間變異率大可用來區分同型病毒的亞群。NS3序列的差異可用於區分同種血清型的野毒株和弱毒活疫苗株,2.3%~9.7%的變異率就足以進行區分,尤其是與系統進化分析聯合套用時。
ASHVNS3的種系發生研究將NS3蛋白分成3個不同的種系發生譜系,命名為α,β和γ[13]。AHSV-4,5,6,8和9的NS3屬α,ASHV-3,7和8的NS3屬β,ASHV-2的NS3屬γ。雖然3個NS3進化群區別明顯,但是某一特定AHSVNS3屬於哪個進化群並不是只由病毒血清型決定。AHSV的基因重排可以解釋一些較大的變異率。基因重排在分節段基因組的病毒中是自然發生的,如正黏病毒(Orthomyxovirus)和呼腸病毒。多個ASHV血清型混合感染斑馬和馬都可能使得S10片段在不同血清型之間發生重組。NS3表型群的血清型分組提示那些在同一NS3進化群中的血清型病毒更易發生S10基因的交換。
AHSV-3至9的NS3長為217aa,而ASHV-2的NS3蛋白則有218aa。NS3的保守區域包括NS3A的甲硫氨酸起始密碼子,一個脯氨酸富集區(22aa~34aa),43aa~92aa的高度保守區,以及可形成跨膜螺旋的兩個疏水結構域(116aa~137aa和154aa~170aa)[14]。這些結構特徵在其他環狀病毒包括BTV的NS3蛋白中很普遍。BTVNS3的兩個疏水區域跨越胞膜[15]。BTVNS3還有糖基化位點,此糖基化作用可以阻止BTVNS3降解[15]。除了一些保守特性,AHSVNS3與BTVNS3有很大的不同。沒有證據表明AHSVNS3的糖基化有重要作用,因為某些病毒血清型的NS3沒有推測的糖基化序列。BTVNS3在桿狀病毒表達系統中高水平表達,而AHSVNS3的表達水平低,只能以免疫印跡或放射性標記法來檢測。
AHSVNS3中大部分有差異的胺基酸存在於3個區域,即N端的43個胺基酸,93aa~153aa之間和C端的15個胺基酸。變異最大的區域(變異率為82.4%)位於136aa~153aa之間。ASHV除了AHSV-2,所有血清型的NS3蛋白在第123aa處有一保守的
半胱氨酸,ASHV-2NS3蛋白的半胱氨酸在第120aa處,而第2個半胱氨酸(164aa)在所有血清型中都保守。此外,還有一個高度保守的N-十四烷基化基序(60aa~65aa或59aa~64aa),位於蛋白在細胞膜上的錨定區域。在十四烷基化基序的末端是一個帶陽性電荷的胺基酸區域。這兩個特點都在上述所說的43aa~92aa的高度保守區域內。與其它環狀病毒的NS3蛋白比較,所有這些蛋白的氨基末端區域的N-十四烷基化基序高度保守。僅僅十四烷基化還不能給蛋白提供足夠的能量使之附著在磷脂雙層膜上。其他病毒的膜相關/結合蛋白,如Ⅰ型人類免疫缺陷病毒(Humanimmunodeficiencyvirus,HIV-1)的Gag蛋白和勞氏肉瘤病毒的Src蛋白,含有一個鹼性胺基酸區域,它能穩定膜的相互作用。所有環狀病毒NS3蛋白中有一個類似的二聯基序,它可能是NS3蛋白的膜靶向信號。
ASHVNS3的兩個疏水區與細胞毒性效應有關。任意一個疏水區的變異不會改變蛋白對膜的靶向性,但能解除它們在膜上的錨定,從而阻止它們在細胞表面的定位並消除它們的細胞毒性效應。桿狀病毒表達的AHSVNS3對昆蟲細胞(Spodopterafrugiperda,Sf9細胞)的細胞毒性效應是通過改變細胞膜的通透性而實現的。
防制
預防:尚無有效藥物治療。感染區應對未感染馬進行免疫接種,如多價苗、單價苗(適用於病毒已定型)、單價滅活苗(僅適用於血清4型)。
中國尚未發現此病,為防止從國外傳人,禁止從發病國家輸入易感動物。
處理:發生可疑病例時,按《中華人民共和國動物防疫法》規定,採取緊急、強制性的控制和撲滅措施。採樣進行病毒鑑定,確診病原及血清型,撲殺病馬及同群馬,屍體進行深埋或焚燒銷毀處理。採用殺蟲劑、驅蟲劑或篩網捕捉等控制媒介昆蟲。
相關法規
1999年5月10日,
辛巴威農業部向OIE報告了辛巴威於1999年2月爆發了非洲馬瘟。為防止該病傳入我國,保護我國的畜牧業安全,根據《中華人民共和國進出境動植物疫法》第五條,特公告如下:
一、自公告之日起,禁止直接或間接從辛巴威輸入馬屬動物及其產品。
二、禁止郵寄或旅客攜帶來自辛巴威的馬屬動物產品進境,一經發現,一律作銷毀處理。
三、對途徑我國或在我國停留的國際航行航舶,飛機和火車等,如發現有來自辛巴威的馬屬動物及其產品,一律作封存處理;對上述運輸工具上的動植物性廢棄物,泔水等由口岸動植物檢疫機關作無害化處理。
四、凡截獲的走私入境的來自
辛巴威的馬屬動物及其產品,一律在就近口岸動植物檢疫機關監督下作銷毀處理。
五、凡違反上述規定者,由口岸動植物檢疫機關依照《中華人民共和國進出境動植物檢疫法》等有關規定處理。
 非洲馬瘟
非洲馬瘟 非洲馬瘟
非洲馬瘟 非洲馬瘟
非洲馬瘟 非洲馬瘟
非洲馬瘟 非洲馬瘟
非洲馬瘟 非洲馬瘟
非洲馬瘟 非洲馬瘟
非洲馬瘟 非洲馬瘟
非洲馬瘟 非洲馬瘟
非洲馬瘟 非洲馬瘟
非洲馬瘟
