基本性質
非晶體又稱無定形體內部原子或分子的排列呈現雜亂無章的分布狀態的固體稱為非晶體。 如玻璃、瀝青、松香、塑膠、石蠟、橡膠等。非晶態固體包括非晶態電介質、非晶態半導體、非晶態金屬。它們有特殊的物理、化學性質。例如金屬玻璃(非晶態金屬)比一般(晶態)金屬的強度高、彈性好、硬度和韌性高、抗腐蝕性好、導磁性強、電阻率高等。這使非晶態固體有多方面的套用。它是一個正在發展中的新的研究領域,得到迅速的發展。
晶體與非晶體之間在一定條件下可以相互轉化。例如,把石英晶體熔化並迅速冷卻,可以得到石英玻璃。將非晶半導體物質在一定溫度下熱處理,可以得到相應的晶體。可以說,晶態和非晶態是物質在不同條件下存在的兩種不同的固體狀態,晶態是熱力學穩定態。
形成條件
熱力學條件
熔融體是物質在熔化溫度以上的一種高能量狀態,隨著溫度的下降,根據熔體釋放能量的大小不同,可以有三種冷卻過程。
1、結晶化。熔體中的質點進行有序排列,釋放出結晶潛熱,系統在凝固過程中始終處於熱力學平衡的能量最低狀態。
2、玻璃化。質點的重新排列不能達到有序化程度,固態結構仍具有熔體遠程無序的結構特點,系統在凝固過程中,始終處於熱力學介穩狀態。
3、分相。熔體在冷卻過程中中,不再保持結構的統計均勻性,質點的遷移使系統發生組分偏聚,從而形成互補混溶並且組成不同的兩個玻璃相,分相使系統的能量有所下降,但仍處於介穩態。
從熱力學觀點分析,非晶態物質總是有降低內能,向晶態轉化的趨勢。在一定條件下,通過析晶或分相放出能量,使系統處於低能量、更加穩定的狀態。
結晶化學條件
形成玻璃要避免析晶,過冷度大,冷卻速度快,防止成核並變大。
1、鍵參數。 主要從結晶化學角度,根據原子參數或鍵參數的大小來說明物質形成非晶態的能力。
對於氧化物玻璃 ,一般認為是一種無規網路結構,從陽離子在構成這一無規網路結構中可能起的作用,把它們分成了三類 :
第一類本身可以構成玻璃結構,稱為玻璃網狀形成體。 如 B 、Si、Ge、P、Al;
第二類屬於起調整作用的,稱為網路調整體,如Pb;
第三類的作用在前兩類之間。
這一 分類與場強z/a2(其中z為陽離子電荷,a 為正負離子間距 ) 、 單鍵強度 、 負電性之間的關係如下圖:
 鍵參數與非晶態形成能力
鍵參數與非晶態形成能力定性地說 ,z/a2、單鍵強度、 負電性越大,形成玻璃能力越強。 這一規律雖然主要是從氧化物玻璃形成的經 驗中總結出來的,但是對指導目前金屬非晶態製備,也是有意義的。事實上,目前相 當多的非晶態合金材料在摻入了如 Si、 P 之類元素之後更易於形成非晶態。
2、鍵型。化學鍵的特性是決定物質結構的主要因素,也是影響非晶態結構能否形成的主要因素。一般而言,具有極性共價鍵和半金屬共價鍵的元素才能形成非晶態。
一般正負離子的電負性差值約在1.5~2.5之間,其中正離子有極強的極化力。單鍵強度>335kJ.mol-1的化合物,在能量上有利於形成底配位數的原子團結構如[SiO4]、[BO3],這些原子團連線成鏈狀、層狀、或架狀,熔融時黏度很大,冷卻時分子團聚集成無規則網路,傾向於形成非晶態結構。
動力學條件
從結晶動力學理論出發的討論,把非晶態的形成過程看成是成核率很小,或晶核長速度很小的過程,也就是 直接把晶體 長的成核、生長理論套用於非晶態的形成。
相互區別
本質區別
晶體有自范性,非晶體無自范性。
物理性質
晶體是內部質點在三維空間成周期性重複排列的固體,具有長程有序,並成周期性重複排列。
非晶體是內部質點在三維空間不成周期性重複排列的固體,具有近程有序,但不具有長程有序。外形為無規則形狀的固體。
晶體有各向異性,非晶體多數是各向同性。晶體有固定的熔點,非晶體無固定的熔點,它的熔化過程中溫度隨加熱不斷升高。
微觀結構
晶體和非晶體所以含有不同的物理性質,主要是由於它的微觀結構不同。
組成晶體的微粒——原子是對稱排列的,形成很規則的幾何空間點陣;空間點陣排列成不同的形狀,就在巨觀上呈現為晶體不同的獨特幾何形狀;組成點陣的各個原子之間,都相互作用著,它們的作用主要是靜電力;對每一個原子來說,其他原子對它作用的總效果,使它們都處在勢能最低的狀態,因此很穩定,巨觀上就表現為形狀固定,且不易改變;晶體內部原子有規則的排列,引起了晶體各向不同的物理性質;如果外力沿平行晶面的方向作用,則晶體就很容易滑動(變形),這種變形還不易恢復,稱為晶體的范性;從這裡可以看出沿晶面的方向,其彈性限度小,只要稍加力,就超出了其彈性限度,使其不能復原,而沿其他方向則彈性限度很大,能承受較大的壓力、拉力而仍滿足虎克定律;當晶體吸收熱量時,由於不同方向原子排列疏密不同,間距不同,吸收的熱量多少也不同,於是表現為有不同的傳熱係數和膨脹係數。 而非晶體一般沒有這結構。
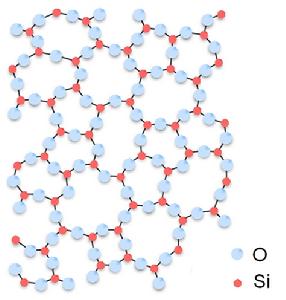 非晶體—玻璃態二氧化矽(SiO2)的結構圖
非晶體—玻璃態二氧化矽(SiO2)的結構圖X射線衍射實驗
當單一波長的X射線通過非晶體時,不會在記錄儀上看到分立的斑點或明銳的譜線,而同一條件下攝取的晶體圖譜中能看到分立的斑點或明銳的譜線。
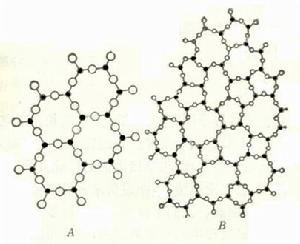 A為晶體 B為非晶體
A為晶體 B為非晶體非晶體熔化
當晶體從外界吸收熱量時,其內部分子、原子的平均動能增大,溫度也開始升高,但並不破壞其空間點陣,仍保持有規則排列。繼續吸熱達到一定的溫度——熔點時,其分子、原子運動的劇烈程度可以破壞其有規則的排列,空間點陣也開始解體,於是晶體開始變成液體。
在晶體從固體向液體的轉化過程中,吸收的熱量用來一部分一部分地破壞晶體的空間點陣,所以固液混合物的溫度並不升高。當晶體完全熔化後,隨著從外界吸收熱量,溫度又開始升高。而非晶體由於分子、原子的排列不規則,吸收熱量後不需要破壞其空間點陣,只用來提高平均動能,所以當從外界吸收熱量時,便由硬變軟,最後變成液體。
 鍵參數與非晶態形成能力
鍵參數與非晶態形成能力 非晶體—玻璃態二氧化矽(SiO2)的結構圖
非晶體—玻璃態二氧化矽(SiO2)的結構圖 A為晶體 B為非晶體
A為晶體 B為非晶體