電位-pH圖的計算
電位-pH圖中涉及的化學反應的類型可分為:
有電子無H+參與的反應,如:Fe2++2e=Fe;
無電子有H+參與的反應,如:ZnO+2H2+=Zn2++H2O;
有電子有H+參與的氧化-還原反應,如:Fe(OH)3+3H++e==Fe2++H2O;
無電子無H+參與的化學反應,如:2Na[Ag(CN)2]+Na2S=Ag2S+4NaCN;
E-pH圖
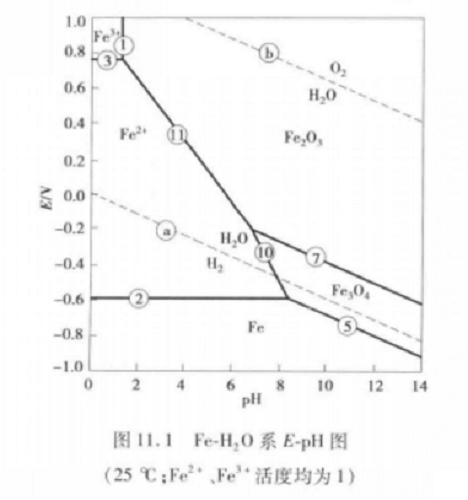
E-pH圖的繪製濕法冶金中典型電位pH圖有Fe-H2O系電位-pH圖,Fe-H2O系兼有水溶液化學反應全部4種類型,此體系最適合用來闡述浸出反應的熱力學處理的基本原理,它在腐蝕、礦物沉積和濕法冶金中都有重要的地位。
金屬-配位體-水系的電位-pH圖
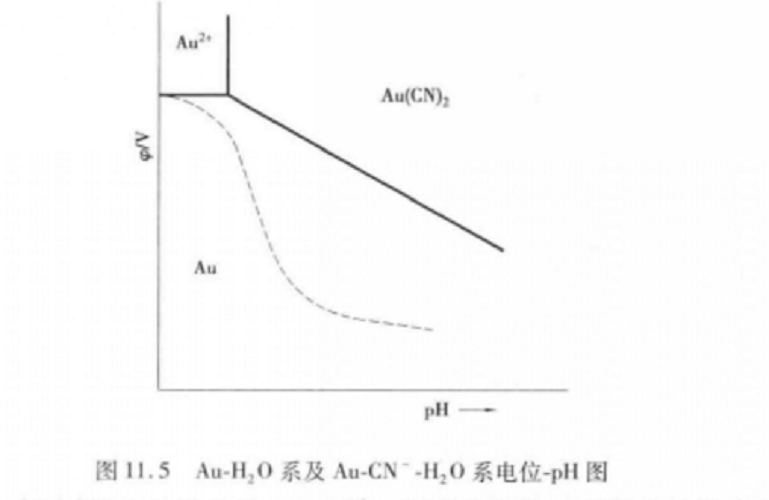
金屬-配位體-水系的電位-pH圖最簡單的電位-pH圖只涉及一種元素的不同氧化態與水構成的體系,但實際溶液中往往有配位體(如CI-、CN-、SO44+等)存在。此時溶液中除有簡單離子外,還會出現配位體與金屬離子形成的絡離子,結果使離子形式很複雜,金屬離子的活度降低,金屬-配位體-水系的電位-pH圖形發生變化。絡合情況越嚴重,圖形變化越大。如Au-H2O系如果變為Au-CN--H20系,由於存在反應:Au2++2CN-=Au(CN)2而使之變為圖中虛線所示。