基本介紹
- 中文名:零水準
- 外文名:zero lever
- 套用學科:無機及分析化學
- 別稱:參考水準
定義,選擇條件,建立質子平衡式,步驟,舉例,簡化[ H+]的計算,一元弱酸,二元弱酸,緩衝溶液,兩性物質,
定義
在書寫質子平衡式時,通常選擇在溶液中大量存在並參與質子傳遞的物質作為參照物,如溶劑和溶質本身,這些物質稱為零水準。
選擇條件
根據質子條件表示式的合義零水準的選擇應該是:
1、凡是能和水產生質子傳遞的外來酸鹼以及水本身都是零水準。即加到體系中的所有酸鹼反應物,其量不論 多少都列入零水準。
2、凡是能和外來酸鹼和水質子傳遞的產物的產物都不應列入零水準。
例如,一 元弱鹼B水溶液的零水準是B和H2O。質子條件式只能是[H+]=[OH-]+[B],不能選擇質子傳遞產物HB作為零水準。因 為在質子轉移達到平衡後水向弱鹼B供出質子的摩爾數等於水從弱酸HB中得到質子的摩爾數,即水獲得的淨的質子的摩爾數為零,二者質子條件式不等效。
3、只要水從外來酸鹼得到的淨的質子摩爾數不變,零水準的選擇不受限制。
非淨的質子的摩爾數看作外來酸鹼的質子轉移,此過程不影響溶液的酸度。
4、多元弱酸或或多元弱鹼與水質子傳遞過程中的酸式酸根,不列入零水準。
多元弱酸或多元弱鹼生成的酸式酸跟,雖然仍可參與質子轉移,但轉移質子的總摩爾數與起始物直接轉移到同一級時質子的摩爾數相等。
建立質子平衡式
步驟
1、從酸鹼平衡系統中選取質子零水準,它們是溶液中大量存在並參與質子轉移的物質,通常是起始酸鹼組分,包括溶劑分子。
2、根據質子參考水準判斷得失質子的產物及其得失質子的量。
3、根據得失質子的量相等的原則,得質子產物的物質的量濃度之和等於失質子產物的物質的量濃度之和,寫出質子條件式。注意,質子條件式中不應出現質子參考水準本身和與質子轉移無關的組分,對於得失質子產物在質子條件式中其濃度前應乘以相應的得失質子數。
舉例
如C(mol·L-1)的Na2HPO4溶液中存在如下平衡:
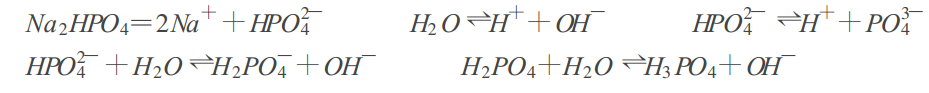
建立質子平衡式比較困難,若將溶液中原有的且與質子轉移有關的分子和離子作為零水準物質(本例中為H2O 、HPO42-)並找出得失質子的產物和得失質子數的關係,如下表:
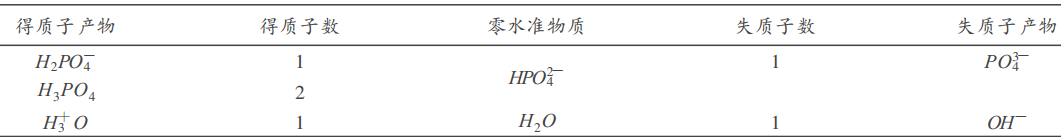
根據形成得質子產物得到質子的數目=形成失質子產物失去質子的數目,建立質子平衡式:
[H2PO4-]+2[H3PO4]+[H+]=[PO43-]+[OH-],顯得很方便。
簡化[ H+]的計算
計算溶液[ H+]濃度時 ,根據質子平衡式引入零水準物質的濃度和有關常數,建立一個基本公式形式,再根據不同情況,再分別進行近似處理。
一元弱酸
如計算C(mol·L-1)的一元弱酸HA 溶液中的[H+]濃度。
零水準物質是HA 和H2O
由質子平衡式:[H+]=[A-]+[OH-]=Ka*[HA]/[H+]+Kw/[H+]
得[H+]= Ka*[HA]+Kw ①
據MBE:C=[HA]+[A-];PBE :[H+]=[OH-]+[A-]
得[HA]=C-[A-]=C-[H+]+[OH-]
(1)若規定計算中Er ≤5%,當[A-]>20[OH-],說明溶液中的H+絕大部分由HA 電離產生。
[ H+] ≈[ A-] ,[ HA] ≈C -[ H+] ,由此產生的誤差即使在[ OH-] =1/20[ A-] 時:
[ Er] = {[ A-] -([ A-] +[ OH-] )}/([ A-] +[ OH-] ) ×100 %
= |-[ OH-] /{[ OH-] +20[ OH-] } |×100 %
=4.8 %<5 %(符合規定)
則①式簡化為:[ H+]2 = Ka(C -[ H+] )+Kw
(2)當 Ka*C ≥20 Kw 時,可以忽略 Kw 項(其產生的最大相對誤差 Er =4.1 %<5 %, 分析方法同上)。
得:[ H+] 2= Ka(C -[H+]) ②
(3)若 C/Ka ≥400 時,C -[ H+] ≈C,得[ H+] = KaC +Kw ;
當 C/Ka ≥400 時 , C ≈c -[ H+] 所產生的誤差討論:
即使 C/Ka=400 時
按②式計算:[ H+] = KaC=20Ka;
按③式計算:[ H+]2 = Ka(C- [H+],[ H+] =19.5Ka
Er =(20Ka-19.5Ka)/19.5Ka ×100 %=2.6 %,符合規定。
(4)若 C/Ka ≥400,C*Ka ≥20Kw 時;得[ H+] = Ka*C ③
即便是複雜的體系, 用零水準法建立合適的公式形式, 也便於選擇合適的近似處理方法。
二元弱酸
如計算C(mol·L-1)的二元弱酸H2A 溶液的[H+]濃度。
零水準物質是H2A 和H2O,計算[H+]時,在質子平衡式中代入零水準物質的濃度[H2A]:
[H+]=Ka1[H2A]/[H+]+2*Ka1Ka2[H2A]/[H+]2 +Kw/[H+] ④
以上式為基礎進行討論,建立適合具體條件的近似公式很方便。
[ H2A] =C -[ HA-] -[ A2-] =C -[ H+] +[ OH-] +[ A2-]
由於多元弱酸是逐級電離, 如果各級電離常數相差較大,且逐級減小
則[ H2A] ≈C -[ H+] +[ OH-]
(1)當[ HA-] ≥20Kw 時,[ H2A] ≈C -[ H+]
④ 式可近似為[ H+]2 = Ka1*(C -[ H+] )*(1 +2Ka2/[ H+] )+Kw
(2)當 CKa1 ≥20Kw 時,忽略 Kw 項
得近似公式:[ H+]2 = Ka1(C -[ H+] )(1 +2Ka2/[ H+])
(3)當 CKa1 ≥20Kw,Ka2/ [ H-] ≈2Ka2/ CKa1 ≤1/20 時,忽略 Kw 項和2Ka2/[ H+] 項
得近似公式[ H+]2= Ka1(C -[ H+])
(4)當 CKa1≥20Kw 時,C/Ka1≥400,2Ka2/[ H+] ≈2Ka2/ CKa1 ≤1/20 時
得近似公式 :[ H+] 2= Ka1C
緩衝溶液
以 Ca(mol·L-1)的 HA 和Cb(mol·L-1)的 NaA 組成的緩衝溶液為例 。
溶液中的平衡:NaA=Na++A-
HA =H+ +A-
A-+H2O= HA +OH-
H2O =H+OH-
零水準物質 :HA 、A-、H2O
Ka =[ H+]* [ A-] /[ HA], pH =PKa +lg[ A-] /[ HA] ⑤
Ka =[ H+]* [ A-] /[ HA], pH =PKa +lg[ A-] /[ HA] ⑤
[ H+] +[ Na+] =[ A-]+[ OH-],Cb =[ Na+]
得[A-]=Cb+[H-]-[OH-]
Cb +Ca=[ HA] +[ A-]
得[ HA] =Cb +Ca-[ A-] =Ca-[ H+] +[ OH-] 代入⑤式
PH =PKa +lg{(Cb-1 *[ H-1] -[ OH-] )/(Ca -[ H-1] +[ OH-]
兩性物質
對於 C(mol·L-1)的 NaHA 溶液 PBE:[ H+] +[ H2A] =[ A2-] +[ OH-]
零水準物質是 HA,H2O
代入零水準物質的濃度[ HA-] 於PBE中:
得[ H+] +[ H+] [ HA-] /Ka1 =Ka2[ HA-] /[ H+] +Kw/[ H+]
[ H+] (1 +[ HA-] /Ka1)=Ka2[ HA-] /[ H+] +Kw/[ H+]
[ H+]2 = (Ka2[ HA-] +Kw)/(1 +[ HA-] /Ka1)
(1)若 Ka1,Ka2相差較大, 則[ HA-] ≈C,若Ka2C ≥20Kw 可忽略 Kw
得[ H+] = Ka2C/(1 +C/Ka1)
(2)若 C/Ka1 ≥20,則1+C/Ka ≈C/Ka1
得[ H+] = Ka1*Ka2
