基本介紹
- 中文名:離子晶體結構
- 外文名:Ionic crystal structure
- 形成元素:Li,Na,K,Rb,Cs等
- 結合鍵:離子鍵
- 結構基礎:正、負離子最大、小靜電引力
- 特點:硬度高、強度大、熔點和沸點較高
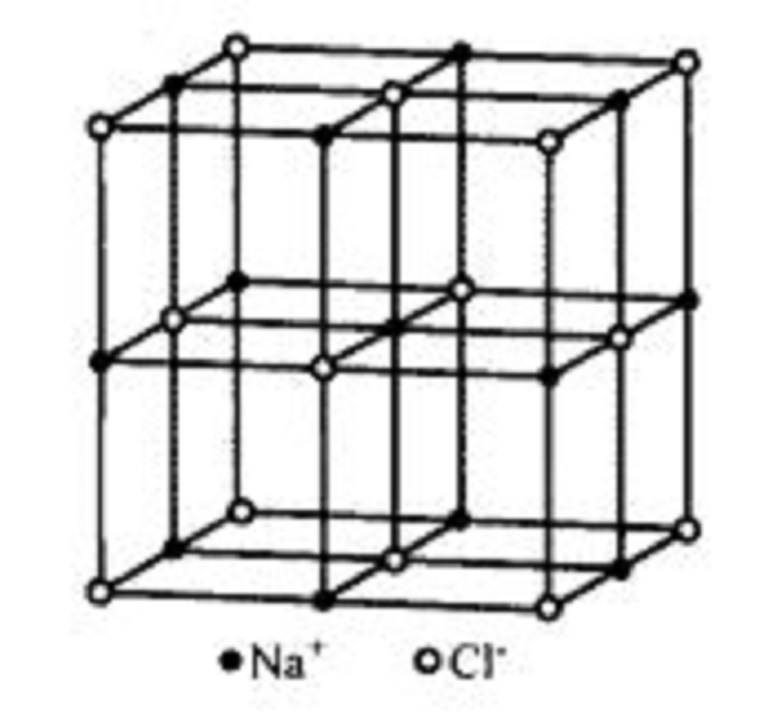
多數鹽類鹼類和金屬氧化物的晶體結構都是離子晶體結構。典型的離子晶體是元素周期表中I A族的鹼金屬元素Li,Na,K,Rb,Cs和VI A的鹵族元素F,CI,Br,I之間形成的...
晶體主要分為離子晶體、分子晶體、金屬晶體和原子晶體。離子晶體是指由離子化合物結晶成的晶體,離子晶體屬於離子化合物中的一種特殊形式,不能稱為分子。由正、負...
離子晶格(ionic crystal lattice)是晶體結構中質點間的結合以離子鍵占主導地位的晶格。組成離子晶格的質點是離子(包括絡離子),陽離子大多具有中等數值(6左右)的配...
晶體以其內部原子、離子、分子在空間作三維周期性的規則排列為其最基本的結構特徵。任一晶體總可找到一套與三維周期性對應的基向量及與之相應的晶胞,因此可以將...
離子晶體半徑是描述離子大小的參數。取決於離子所帶電荷、電子分布和晶體結構型式。設r陽為陽離子半徑,r陰為陰離子半徑。r陽+r陰=鍵長。r陽/r陰與晶體類型有...
晶體(crystal)是由大量微觀物質單位(原子、離子、分子等)按一定規則有序排列的結構,因此可以從結構單位的大小來研究判斷排列規則和晶體形態。...
氟化鈣型結構也稱螢石型結構,是面心立方結構。晶胞中心有一個很大的空位,正負離子的配位數分別為8和4。對該結構,也可以把Ca離子看成按“立方密堆”,而F-離子...
金紅石型結構是指以金紅石(二氧化鈦的一種)為代表的一類AB2型化合物的離子晶體結構。屬四方晶系。其中陰離子B(如O2-)作近似六方密堆積,陽離子A(如Ti4+)填充...
研究晶體在原子水平上的結構理論,揭示晶體的化學組成、結構和性能三者之間的內在聯繫以及有關原理的物理化學分支學科。...
鈮酸鉀KNbO3為優異的非線性光學晶體,屬鈣鈦礦結構,其晶胞這樣構成:K+離子占據立方體角頂位置,Nb5+占據體心位置,O2-占據面心位置。...
尖晶石(MgAl2O4)型結構。該晶體結構中,氧離子按立方緊密堆積排列,二價陽離子充填於八分之一的四面體空隙中,三價陽離子充填於二分之一的八面體空隙中。通式AB...
分子晶格是指晶體結構中質點間的結合以分子鍵占主導地位的晶格。在分子晶格中存在著真實的分子,分子間以分子鍵結合,分子內部的質點則以離子鍵或共價鍵結合。分子...
晶格能是指在標準狀況下,使離子晶體變成氣態正離子和氣態負離子時所吸收的能量,它是度量晶格穩定性的參數。影響晶格能大小的因素有離子半徑、離子電荷以及離子的電子...
