基本介紹
簡介
晶體的特徵
三種離子晶體
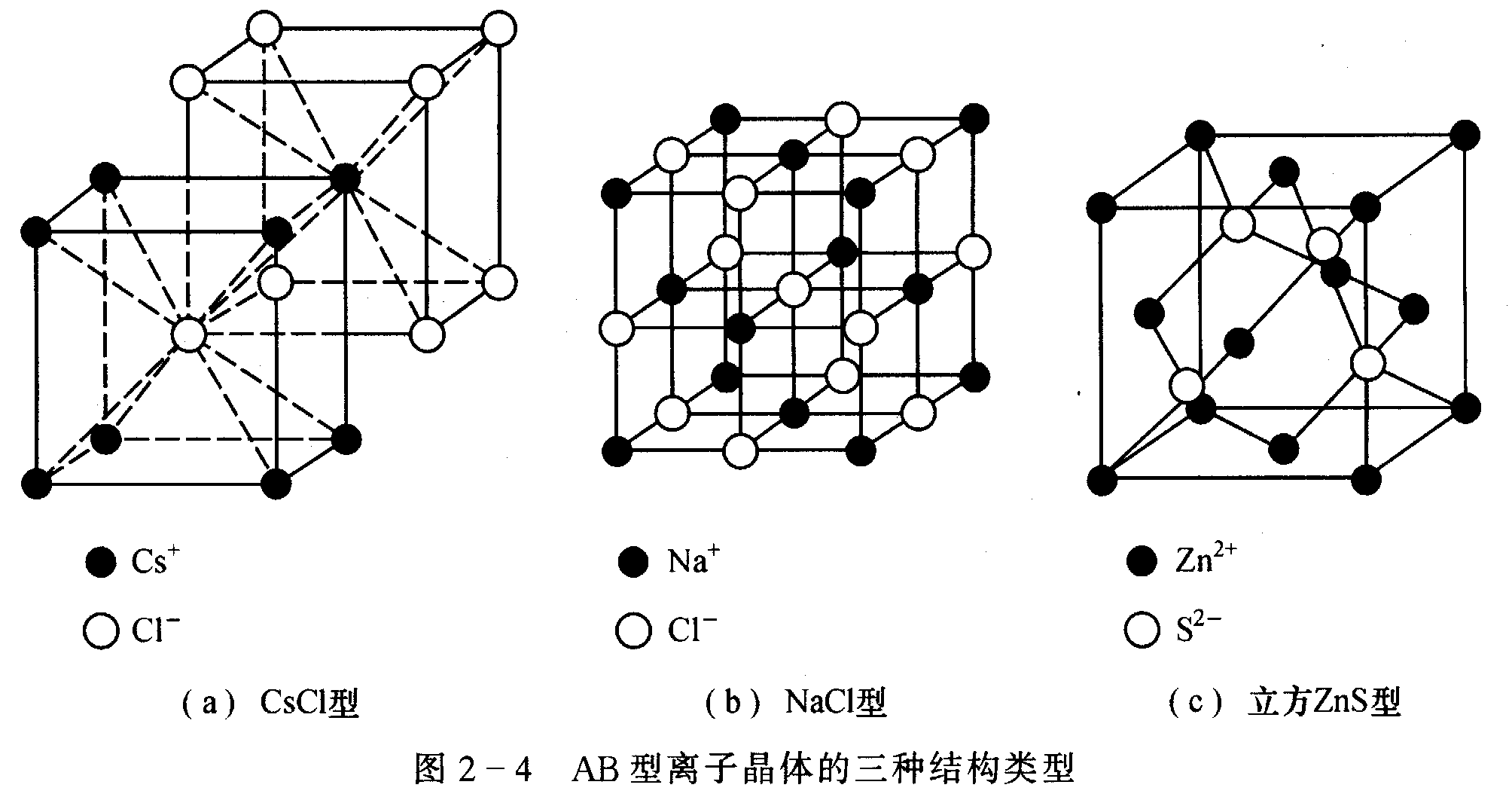 圖2-4
圖2-4
 圖2-4
圖2-4分子晶格是指晶體結構中質點間的結合以分子鍵占主導地位的晶格。在分子晶格中存在著真實的分子,分子間以分子鍵結合,分子內部的質點則以離子鍵或共價鍵結合。分子...
分子間通過分子間作用力(根據人教版教材最新解釋,分子間作用力又名范德華力,而氫鍵不是化學鍵,是一種特殊的分子間作用力,屬於分子間作用力)構成的晶體。構成微粒:...
晶格中的每個的點稱為結點。晶格中各種不同方位的原子面,稱為晶面。晶格意義 編輯 概念源於晶體學點陣。晶體學點陣是體現晶體結構內離子、原子、分子等在三維空間...
晶體(crystal)是由大量微觀物質單位(原子、離子、分子等)按一定規則有序排列的結構,因此可以從結構單位的大小來研究判斷排列規則和晶體形態。...
由處理固體溶液發展而來的一種溶液理論,是描述大小相近的球形分子所構成的溶液的理論。...
三方晶系晶體採用的一種正當晶格型式。三方R(素)晶格的晶格參數具有a=b=c, α=β=γ<120 ≠90 的特徵。三方晶系亦可採用A=B≠C,α=β=90 ,γ=120 的...
晶體以其內部原子、離子、分子在空間作三維周期性的規則排列為其最基本的結構特徵。任一晶體總可找到一套與三維周期性對應的基向量及與之相應的晶胞,因此可以將...
分子金屬,是指一種在分子水平上研究出新型的金屬導體。...... 近年來英國的昂德希爾教授設計出一種“分子金屬”,平面狀的分子呈層狀堆砌成晶體,每個分子中的金屬原...
Leech 晶格(英語:Leech lattice),是24維歐幾里得空間的一種雙麼模晶格。它是24維歐幾里得晶格中,最短向量長度是4的唯一晶格。...
大分子指相對分子質量在5000以上,甚至超過百萬的生物學物質,如蛋白質、核酸、多糖等。它與生命活動關係極為密切,由被認為單體的簡單分子單位所組成。在溶液中有形成...
晶體學中的一個重要的領域,它研究晶態物質內部在原子尺度下的微觀結構。它為固體物理學、材料科學、結構化學、分子生物學、礦物學、醫藥學等許多學科的基礎研究和...
《晶體的結構》是2011年出版的圖書,作者是B K伐因斯坦、V M弗里特金、V L英丹博姆。本書可供固體物理、材料科學、金屬學、礦物學、化學、分子生物學等專業的...
自組裝 (self-assembly) 為系統之構成元素(components;如分子)在不受人類外力之介入下,自行聚集、組織成規則結構的現象。例如分子的結晶即是一種自組裝現象。...
然而晶體生長的實際情況要比簡單層生長理論複雜得多.往往一次沉澱在一個晶面上的物質層的厚度可達幾萬或幾十萬個分子層.同時亦不一定是一層一層地順序堆積,而是一...
三鏈DNA分子晶格振動模式的理論研究論文作者是孟耀勇,是劉頌豪,龔立三,廖常俊教授指導。...
從衍射花樣(衍射線的方向和強度)推算生物大分子的三維結構(也常稱空間結構、立體結構或構象)的技術。其主要原理是 X射線、中子束或電子束通過生物大分子有序排列...
等。晶面的方位不是用角度而是用晶面指數來表示,其通式為(hkl)或{hkt},前者表示一組平行的晶面;後者表示一族原子或分子排列完全相同的所有晶面。同一晶體中,...
