原理
1、根據蛋白質的等電點(第一向)和分子量(第二向)的不同進行分離。
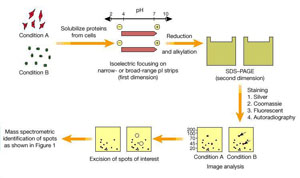
2、電泳後根據蛋白質的上樣量對膠進行考馬斯亮蘭染色、
銀染或螢光染色,然後用相關軟體對電泳圖象進行分析。
操作步驟
樣品要求
1、建議使用的蛋白質溶解體系為8M
尿素/4%CHAPS /40mMTris(Base)/65mM DTT;
2、樣品濃度大於2 μg/ μl;
樣品製備
雙向電泳成功的關鍵在於建立一套有效的、可重複的樣品製備方法。樣品製備的影響因素包括蛋白質的溶解性、分子量、電荷數及
等電點等。對於不同的
樣品性質及研究目的,其方法也不盡相同。不同的樣品性質, 用於
樣品處理的
緩衝液必須在低離子強度的基礎上,既能保持蛋白質的天然電荷。又能維持其溶解性。因此,絕大多數樣品往往都需要通過多次實驗才能摸索到最適宜的條件。
第一向分離
等電聚焦
蛋白質是兩性分子,在不同的pH環境中可以帶正電荷、
負電荷或不帶電荷。對每個蛋白質來說都有一個特定的pH,此時蛋白質的
靜電荷為零,此pH值即該蛋白質的
等電點(pI)。將蛋白質樣品載入至pH梯度介質上進行電泳時,它會向與其所帶電荷相反的電極方向移動。在移動過程中,蛋白分子可能獲得或失去
質子,並且隨著移動的進行,該蛋白所帶的電荷數和遷移速度下降。當蛋白質遷移至其
等電點pH位置時,其
淨電荷數為零,在
電場中不再移動。聚焦是一個與pH相關的平衡過程:蛋白質以不同的速率靠近並最終停留在它們各自的
pI值;在等電聚焦過程中,蛋白質可以從各個方向移動到它的恆定位點。
第二向分離
SDS.聚丙烯醯胺凝膠電泳
雙向電泳的第二向是將IPG膠條中經過第一向分離的蛋白轉移到第二向SDS.PAGE凝膠上,根據蛋白相對分子質量或分子量(MW)大小與第一相垂直的分離。
蛋白質與
十二烷基硫酸鈉(SDS)結合形成帶負電荷的蛋白質.SDS複合物,由於SDS是一種強陰離子去垢劑.所帶的負電荷遠遠超過蛋白質分子原有的
電荷量,能消除不同分子之間原有的電荷差異,從而使得凝膠中
電泳遷移率不再受蛋白質原有電荷的影響.而主要取決於蛋白質分子的質量大小,其遷移率與分子量的對數呈
線性關係,在
蛋白質組研究中。需要在同樣的條件下同時走多塊膠,這對凝膠與凝膠之間的比較十分重要。
修飾和加工
蛋白質的
翻譯後修飾和加工,是指在
肽鏈合成完成後進行的化學反應,如
磷酸化、
羥基化、
糖基化、
二硫鍵形成,以及目前發現的蛋白質
自剪接等等,可能有一百種以上。
翻譯後修飾和加工對蛋白質的正常生理功能是必需的,它們的變化往往和疾病的發生有關。用雙向凝膠電泳可以進行
翻譯後修飾的研究,如用32P標記可以研究磷酸化蛋白的變化。雙向凝膠電泳中常可發現的蛋白質拖曳現象,很可能是一個蛋白的不同
翻譯後修飾產物所造成的。拖曳圖像變化在疾病診斷上可能提供重要的信息。
技術套用
凝膠中蛋白的檢測
凝膠染色的目的是使其中的蛋白質能夠被觀察到。目前還沒有通用的染色方法,只能在考慮多種因素如需要的靈敏度、線性範圍、方便程度、費用、以及成像設備類型等基礎上,結合實際進行選擇。有時也可以將蛋白轉膜後通過
免疫印跡的方法來進行檢測。
圖像採集和分析
成像設備可以攝人圖像,對凝膠圖像以數字形式保存,對每塊凝膠圖像進行平等的比較,在各研究組之間傳遞信息,並對大量的數據進行歸類分析。目前套用較為廣泛的圖像分析軟體有PDQuest、ImageMaster 2D Elite、Melanie、BioImage Investigator等,解析度較高,功能齊全。儘管如此,仍不可避免約10%的未檢出點和假點,需要手工添加、刪除和分割。圖像採集完成後。可以套用各種分析軟體進行分析,可以收集、詮釋、比較
蛋白質組數據資料等。
蛋白鑑定
一旦通過差異分析或其它方法找到感興趣的蛋白後.就可以從凝膠中或膜上切取這些目標蛋白質作鑑定。現在絕大多數蛋白質的鑑定是通過質譜分析來完成的。
分離蛋白質組所有蛋白
分離
蛋白質組所有蛋白的兩個關鍵參數是其解析度和可重複性。在目前情況下,雙向凝膠電泳的一塊膠板(16cm×20cm)可分出3~4千個,甚至1萬個可檢測的蛋白斑點,這與10萬個基因可表達的蛋白數目相比還是太少了。80年代開始採用固定化pH梯度膠,克服了
載體兩性電解質陰極漂移等許多缺點而得以建立非常穩定的可以隨意精確設定的pH梯度。由於可以建立很窄的pH範圍(如0.05U/cm),對特別感興趣的區域可在較窄的pH範圍內做第二輪分析,從而大大提高了解析度。此種膠條已有商品生產,因此基本上解決了雙向凝膠電泳重複性的問題。這是雙向凝膠電泳技術上的一個非常重要的突破。第二向SDS-PAGE有垂直
板電泳和水平超薄膠電泳兩種做法,可分離10~100kD分子量的蛋白質。
其中靈敏度較高的銀染色法可檢測到4ng蛋白,最靈敏的還是用
同位素標記,20ppm的標記蛋白就可通過其
螢光或磷光的強度而測定。用圖像掃瞄器、萊賽密度儀、電荷組合裝置可把用上述方法得到的蛋白圖譜數位化,再經過計算機處理,去除縱向和橫向的曳尾以及背景底色,就可以給出所有蛋白斑點的準確位置和強度,得到布滿蛋白斑點的圖像,即所謂“參考膠圖譜”。
蛋白質組研究的主要困難是對用雙向凝膠電泳分離出來的蛋白,進行定性和定量的分析。最常用的方法是先把膠上的蛋白印跡到PVDF(polyvinylidene difluoride)膜上後再進行分析,確定它們是已知還是未知蛋白。現在的分級
分析法是先做快速的
胺基酸組成分析,也可先做4~5個循環的N末端微量
測序,再做胺基酸組成分析;結合在電泳膠板上估計的等點電和分子量,查對資料庫中已知蛋白的數據,即可作出判斷。有文獻報導,N末端4個殘基序列的數據就可以給出很多的信息而得到相當準確的結果。如再結合C末端序列,判斷結果的準確性會更高。對分離得到的蛋白質作進一步的確切鑑定需要有足夠數量的純蛋白,電泳時蛋白質已經過了高度純化。現在一塊膠板可允許上到高達mg數量級的樣品,因此每個分離的蛋白斑點可有μg數量的蛋白,這樣使本來是微量的蛋白也可希冀被鑑定。
存在問題
(1)
低拷貝蛋白的鑑定。人體的微量蛋白往往還是重要的調節蛋白。除增加雙向凝膠電泳靈敏度的方法外,最有希望的還是把
介質輔助的雷射解吸/離子化
質譜用到PVDF膜上,但當前的技術還不足以檢出拷貝數低於1000的蛋白質。
(2)極酸或極鹼蛋白的分離。
(3)極大(>200kD)或極小(<10kD=蛋白的分離)。
(5)得到高質量的雙向凝膠電泳需要精湛的技術,因此迫切需要自動二維電泳儀的出現。


