基本介紹
- 中文名:陰極
- 外文名:cathode
- 作用 :原電池/電解池中的一極
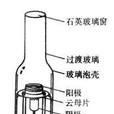
陰極(Cathode)是電化學反應的一個術語。指的是得電子的極,也就是發生還原反應的極。在原電池中,陰極是正極;電子由負極流向正極,電流由正極流向負極。溶液中的陽...
陰極保護技術是電化學保護技術的一種,其原理是向被腐蝕金屬結構物表面施加一個外加電流,被保護結構物成為陰極,從而使得金屬腐蝕發生的電子遷移得到抑制,避免或減弱...
熱陰極與冷陰極電離規穩定性的比較研究電離規作為參考標準或副標準時,穩定性尤為重要。熱陰極型電極:當使用熔點和沸點很高的材料如C,W等做陰極時,陰極可以被加熱...
陰極發射電子的過程。在氣體放電中陰極起著重要作用,它提供電子,維持了電流的循環。在金屬陰極中,電子可以自由運動。但在陰極表面,由於電子和晶格離子之間靜電力的...
金屬離子或氫離子在陰極上獲得電子而被還原的電化冶金過程。對於特定的陰極和電解液,極化還原電位越正(越高)的正離子,越先在陰極上與電子結合而被還原。就一般的...
陰極射線是在1858年利用低壓氣體放電管研究氣體放電時發現的。1897年約瑟夫·約翰·湯姆遜根據放電管中的陰極射線在電磁場和磁場作用下的軌跡確定陰極射線中的粒子帶負...
陰極極化(cathodic polarization)指原電池中的陰極電位,在通過電流之後,向負的方向移動的現象。在電化學研究中,很多電化學反應表現在電極的極化上,因此測量電極的極化...
石墨陰極,其特徵在於陰極炭塊是由粒度小於8毫米的30-60%電煅無煙煤,15-30%焙燒碎,10-50%石墨和15-25%瀝青組成。...
氧陰極又稱為耗氧陰極或者去極化氧陰極(oxygen consuming or oxygen depolarized cathode,簡稱ODC),最先源於氫燃料電池的原理。氧陰極主要套用於燃料電池和鋰空電池...
陰極保護護就是以通電的方法使被保護物成為陰極,由此減緩、避免腐蝕。陰極保護實現的技術有兩種:一是外加電流陰極保護也稱強制(電流)陰極保護,二是犧牲陽極(...
陰極區是指在電弧焊時,電弧緊靠負電極的區域。陰極區很窄,約為10^-6~10^-2厘米。 焊接電弧中,靠近陰極表面的部分叫做陰極區。它不斷地向弧柱發射電子,使...
當真空室內的真空度為13Pa時,在陰陽兩電極之間加上一定的電壓,氣體就會發生自激放電,從陰極發射出的原子或原子團可沉積在陽極或真空室的壁上。這種濺射就稱為陰極...
陰極保護技術是指通過電化學的方法,將需要保護的金屬結構極化,使之電位向負向移動。以達到在環境介質中處於陰極,即被保護狀態的地位的一種方法。陰極保護技術是一...
陰極射線管,是一種能減少陰極加熱器耗電的陰極射線管。其中,旁熱式陰極結構體,具備熱電子發射物質層的金屬基底;在一端的部位上設有保持基底金屬,在內部還設有...
陰極炭塊指的是以優質無煙煤、焦炭、石墨等為原料製成的炭塊。用作鋁電解槽的陰極。它砌築在電解槽底部亦稱底部炭塊。陰極炭塊是鋁電解槽的重要組成部分,有...
陰極螢光光譜(cathodoluminescence spectroscopy)簡稱CL譜,是指利用電子束激發半導體,將價帶電子激發到導帶並在價帶留下空穴,而後由於導帶能量高不穩定,被激發電子又...
簡介 陰極的電極電位。它隨流過電極的電流密度而變化,電流密度增大,陰極電位向負方向移動。 ...
電子管中不用加熱方式而發射電子的陰極。一般利用光電發射,場致發射或二次發射來供給電子。光電管、穩壓管、氖管等的陰極都是冷陰極。習慣上常只把場致發射的陰極...
特性 腐蝕電池中進行還原反應的電極。在陰極上,從陽極流過來的電子被電解質溶液中能夠吸收電子的氧化性物質所接受。在大多數情況下,吸收r:r子的物質是州’和。:...
《半導體光電陰極》是2013年科學出版社出版的圖書,作者是賈欣志。...... 《半導體光電陰極》以半導體光電陰極近50年來的發展為基礎,對歷史進行了粗略的回顧。同時力...
電子或電器裝置、設備中的一種部件,用做導電介質(固體、氣體、真空或電解質溶液)中輸入或導出電流的兩個端。輸入電流的一極叫陽極或正極,放出電流的一極叫陰極...
陰極:發生還原反應的電極(陰極定義)在原電池中,外電路為電子導電,電解質溶液中為離子導電。原電池表示方法 編輯 原電池 為書寫簡便,原電池的裝置常用方便而科學的...
電子管,是一種最早期的電信號放大器件。被封閉在玻璃容器(一般為玻璃管)中的陰極電子發射部分、控制柵極、加速柵極、陽極(屏極)引線被焊在管基上。利用電場對...
將粗銅(含銅99%)預先製成厚板作為陽極,純銅製成薄片作陰極,以硫酸和硫酸銅的混合液作為電解液。通電後,銅從陽極溶解成銅離子(Cu)向陰極移動,到達陰極後獲得...
