鍵焓是指在標準壓強與溫度T時,斷開1mol氣態分子中某化學鍵的焓變稱為該鍵的鍵焓(bond enthalpy)。通常用縮寫符號BE代表鍵焓,也可用符號EHΘm表示。
基本介紹
- 中文名:鍵焓
- 外文名:Bond enthalpy
- 套用學科:化學
- 套用領域:計算反應熱
- 縮寫符號:BE
- 近似值:與鍵能類似
簡介,性質,平均值,近似值,正值,影響鍵焓的因素,鍵焓的套用,
簡介
鍵焓是指在標準壓強與溫度T時,斷開1mol氣態分子中某化學鍵的焓變稱為該鍵的鍵焓(bond enthalpy)。通常用縮寫符號BE代表鍵焓,也可用符號EHΘm表示。
化學鍵具有一定的能量,不同化學鍵其能量。化學變化過程實際上是原子或原子團的重新排列和組合,也是舊鍵斷裂和新鍵形成的過程,斷裂舊鍵需要能量,生成新鍵又放出能量,化學變化的熱效應主要是化學鍵改組時鍵焓的變化。
性質
平均值
例如,對雙原子分子,分子中只有一種鍵,鍵焓即鍵的分解能

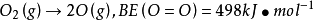
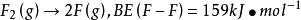

一個H2O(g)兩個分子含有O-H鍵的焓變,也是略有差別。因此,鍵焓應是一種平均近似值,而不是直接實驗的結果。
近似值
鍵焓與鍵能類似,但是鍵焓的計算式為ΔH=ΔU+PΔV,而鍵能是斷鍵時分子內能的變化,相當於ΔU。二者相差了一個PΔV(體積功),一般化學反應在恆壓進行,體積功PΔV沒有或可忽略不計,所以,鍵焓在數值上可近似等於鍵能。

正值
根據鍵焓的定義,斷開化學鍵需要能量,既要吸熱,因此鍵焓都是正值。原子間結合力越強,要斷開這種鍵需要吸收的熱量就越多,鍵焓就越大;反之,鍵焓就越小。所以,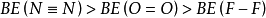 。生產化學鍵時會放熱,焓變就要取負值,生成的鍵越強,放出的熱就越多。
。生產化學鍵時會放熱,焓變就要取負值,生成的鍵越強,放出的熱就越多。
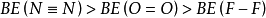
影響鍵焓的因素
(1)原子半徑。一般說來,原子半徑越大(或鍵長越長),鍵焓就越小.
(2)元素電負性。對A-B鍵而言,在鍵長相近的前提下,鍵焓隨著A、B電負性差值的增大(鍵的極性增強)而增大。
(3)成鍵原子軌道的種類。根據價鍵理論,不同原子軌道的成鍵能力是不同的.由於p軌道的成鍵能力比s軌道強,因此,在鍵長相差不特別大的情況下,以p-p軌道鍵合的σ鍵其鍵焓比以s-s軌道鍵合的σ鍵的鍵焓要大些。
(4)孤對電子的作用。當成鍵原子的價電子層中有孤對電子存在時,則孤對電子的排斥作用對成鍵原子的接近是不利的。例如,O-O、N-N、F-F鍵的鍵長雖比C2H6中的C-C鍵長要短,但它們的σ鍵的鍵焓卻比C-C鍵幾乎小2.5倍左右。這是由於對原子半徑很小的O、N、F原子來說,孤對電子的排斥作用比較顯著(因半徑小的原子要充分靠近時才能成鍵),因而降低了鍵的穩定性。但是是對原子半徑大的成鍵原子來說,價電子層中孤對電子云由於分散在較大的空間,其排斥作用相應減弱,因而提高了鍵的穩定性。
鍵焓的套用
利用鍵焓數據可以估算化學反應的焓變,判斷共價化合物的穩定性。因為斷鍵需要能量,既要吸熱,鍵焓是正值;反之成建會放熱,其值為負,所以ΔrHΘm≈∑BE(反應物)-∑BE(產物)=-[∑BE(產物)-∑BE(反應物)]

