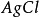沉澱滴定法是通過滴定方式來測定被測物質含量的方法,其中,利用生成難溶性銀鹽來進行測定的方法叫做銀量法 (argentimetry) 。銀量法可以測定銀離子,氯離子,碘離子等,也可以測定經過處理能定量轉化為這些離子的有機物。
基本介紹
- 中文名:銀量法
- 外文名:argentimetry
- 概述:一種沉澱滴定法
- 用途:定量測定被測物質的含量
銀量法的基本原理,銀量法精度要求,銀量法終點的指示方法,鉻酸鉀指示劑法,鐵銨釩指示劑法,吸附指示劑法,標準溶液的配製與標定,其他套用,
銀量法的基本原理
定量分析的原理是以硝酸銀液為滴定液,測定能與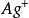 生成沉澱的物質,根據消耗滴定液的濃度和毫升數,可計算出被測物質的含量。
生成沉澱的物質,根據消耗滴定液的濃度和毫升數,可計算出被測物質的含量。
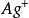
反應式: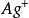 +
+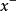 -→AgX↓
-→AgX↓
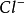
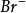
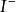


銀量法精度要求
本法的相對偏差不得超過0.3%。
銀量法終點的指示方法
鉻酸鉀指示劑法
- 原理
在中性或者弱鹼性的介質中,用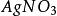 滴定液滴定氯化物、溴化物時採用鉻酸鉀作指示劑的滴定方法。
滴定液滴定氯化物、溴化物時採用鉻酸鉀作指示劑的滴定方法。
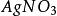
終點反應: 2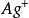 +
+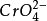 →
→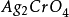 ↓(磚紅色)
↓(磚紅色)
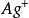
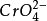
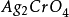
根據分步沉澱的原理,溶度積(Ksp)小的先沉澱,溶度積大的後沉澱。
2.滴定條件
(1)指示劑的用量:指示劑的用量直接影響本方法的準確度。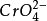 的濃度過高直接提前了滴定終點,且自身顏色影響終點判斷。但是過低也會使終點滯後。實際滴定時,一般在總體積為50到100ml的溶液中加入5%重鉻酸鉀指示劑1到2ml。
的濃度過高直接提前了滴定終點,且自身顏色影響終點判斷。但是過低也會使終點滯後。實際滴定時,一般在總體積為50到100ml的溶液中加入5%重鉻酸鉀指示劑1到2ml。
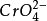
(2)用重鉻酸鉀作指示劑,滴定不能在酸性溶液中進行,因指示劑重鉻酸鉀是弱酸鹽,在酸性溶液中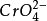 與氫離子結合,使
與氫離子結合,使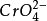 濃度降低過多,在實際的滴定終點推遲形成
濃度降低過多,在實際的滴定終點推遲形成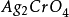 沉澱,甚至不能形成。也不能在鹼性溶液中進行,因為
沉澱,甚至不能形成。也不能在鹼性溶液中進行,因為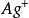 將形成
將形成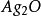 沉澱.因此,實驗證明了用鉻酸鉀指示劑法,滴定只能在近中性或弱鹼性溶液(pH6.5~10.5)中進行。值得注意的是,如果溶液里含有能與
沉澱.因此,實驗證明了用鉻酸鉀指示劑法,滴定只能在近中性或弱鹼性溶液(pH6.5~10.5)中進行。值得注意的是,如果溶液里含有能與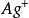 形成配合物的離子存在,例如銨離子,當濃度高到一定的數值,調整PH也不能準確滴定,因AgCl和
形成配合物的離子存在,例如銨離子,當濃度高到一定的數值,調整PH也不能準確滴定,因AgCl和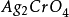 皆可生成配位離子而溶解,在實驗之前必須除去這些例子。
皆可生成配位離子而溶解,在實驗之前必須除去這些例子。
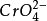
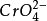
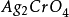
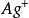
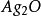
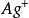
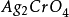
(3)滴定時應該劇烈震搖,震搖可以釋放出被鹵化銀沉澱吸附的鹵素離子,防止終點提前。
3.主要套用範圍
本法多用於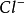 ,
,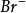 ,
, 的測定,而不能用於
的測定,而不能用於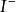 ,
, 。這是因為
。這是因為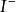 ,
, 形成的銀鹽沉澱對於他們自身有著強烈的吸附作用,震搖也無法釋放
形成的銀鹽沉澱對於他們自身有著強烈的吸附作用,震搖也無法釋放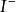 ,
, 。也不適用於用氯化鈉標準溶液直接滴定銀離子,因為在銀離子的試液里滴加重鉻酸鉀指示劑會立刻沉澱,轉化為氯化銀的速度極慢,重點推遲。因此,使用Mohr 法滴定銀離子時必須採用返滴定法。
。也不適用於用氯化鈉標準溶液直接滴定銀離子,因為在銀離子的試液里滴加重鉻酸鉀指示劑會立刻沉澱,轉化為氯化銀的速度極慢,重點推遲。因此,使用Mohr 法滴定銀離子時必須採用返滴定法。
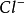
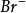

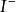

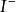

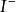

鐵銨釩指示劑法
本方法可以分為直接滴定法和返滴定法
直接滴定法
- 原理
在酸性溶液中,以鐵銨礬為指示劑,用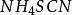 (或KSCN)為標準溶液直接滴定銀離子。
(或KSCN)為標準溶液直接滴定銀離子。
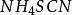
滴定反應為: 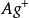 +
+ →AgSCN↓ Ksp =
→AgSCN↓ Ksp =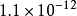
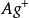

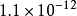
終點時 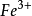 +
+ →
→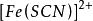 (淡棕紅色)Ksp = 200
(淡棕紅色)Ksp = 200
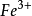

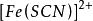
2.滴定條件
(1)滴定應在0.1--1 mol/L 的硝酸介質中進行,如果酸度太低,鐵離子的水解會影響終點判斷。
(2)為了維持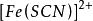 的配位平衡,使能在終點觀察到
的配位平衡,使能在終點觀察到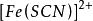 的明顯紅色,需要使終點的鐵離子濃度不超過0.015mol/L。鐵離子濃度太大時自身顏色會干擾終點。
的明顯紅色,需要使終點的鐵離子濃度不超過0.015mol/L。鐵離子濃度太大時自身顏色會干擾終點。
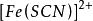
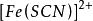
(3)滴定過程中必須充分搖晃,使 得吸附降低到最少。
得吸附降低到最少。

3.套用範圍
直接滴定法用於測量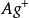 。
。
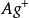
返滴定法
1. 原理
在含有鹵素離子的硝酸溶液里,加入一定量過量的硝酸銀,用鐵銨礬為指示劑,用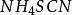 標準溶液返滴定剩餘的過量的硝酸銀。
標準溶液返滴定剩餘的過量的硝酸銀。
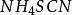
滴定反應 :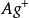 (過量) +
(過量) +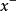 →AgX↓
→AgX↓
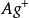
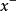
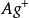

終點反應: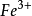 +
+ →
→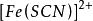 (淡棕紅色)
(淡棕紅色)
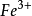

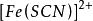
2. 滴定條件
(1)滴定應在0.1--1 mol/L 的硝酸介質中進行,如果酸度太低,鐵離子的水解會影響終點判斷。
(2)強氧化劑,氮的氧化物,以及銅鹽,汞鹽等均會與 反應干擾測定,必須滴定前除去。
反應干擾測定,必須滴定前除去。

(3)測定碘化物的時候,指示劑必須在加入過量硝酸銀之後才能加入,否則會發生鐵離子氧化碘離子的反應,造成了結果的誤差。
(4)測定氯化物的時候,由於AgCl的溶解度大於AgSCN,會發生沉澱的轉化。從而使反應終點的紅色不能出現,或者隨著搖晃而消失造成了誤差。處理方法有兩種:1.將已經生成的氯化銀沉澱過濾,再向剩餘的溶液滴加指示劑; 2.在未加入指示劑之前,先加入1-2ml的硝基苯或者1,2-二氯乙烷,劇烈搖晃。有機試劑會包裹在氯化銀表面,阻止轉化。
3.適用範圍
本法適用於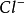 ,
,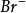 ,
,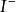 ,
, ,
, 等離子。
等離子。
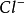
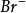
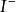


吸附指示劑法
1.原理
用硝酸銀液為滴定液,以吸附指示劑指示終點,測定鹵化物的滴定方法。利用沉澱對有機染料的吸附而改變其顏色來指示滴定終點。吸附指示劑是一些有機染料,它們的陰離子在溶液中很容易被帶正電荷的膠態沉澱所吸附,而不被帶負電荷的膠態沉澱所吸附,並且在吸附後結構變形發生顏色改變。
若以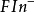 代表螢光黃指示劑的陰離子,則變化情況為:
代表螢光黃指示劑的陰離子,則變化情況為:
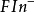
終點前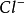 過量(AgCl)
過量(AgCl)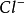 +
+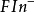 黃綠色
黃綠色
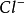
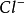
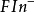
終點時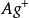 過量
過量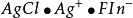 粉紅色
粉紅色
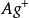
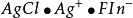
2.滴定條件
為了使終點顏色變化明顯,套用吸附指示劑時需要注意以下幾個問題:
(1)吸附指示劑不是使溶液發生顏色變化,而是使沉澱的表面發生顏色變化。因此,應儘可能使鹵化銀沉澱呈膠體狀態,具有較大的表面。為此,在滴定前應將溶液稀釋並加入糊精、澱粉等親水性高分子化合物以形成保護膠體。同時,應避免大量中性鹽存在,因為它能使膠體凝聚。
(2)膠體顆粒對指示劑離子的吸附力,應略小於對被測離子的吸附力,否則指示劑將在等當點前變色。但對指示劑離子的吸附力也不能太小,否則等當點後也不能立即變色。滴定鹵化物時,鹵化銀對鹵化物和幾種常用的吸附指示劑的吸附力的大小次序如下:
因此在測定Cl-時不能選用曙紅,而應選用螢光黃為指示劑。
(3)溶液的pH應適當,常用的吸附指示劑多是有機弱酸,而起指示劑作用的是它們的陰離子。因此,溶液的pH應有利於吸附指示劑陰離子的存在。也就是說,電離常數小的吸附指示劑,溶液的pH就要偏高些;反之,電離常數大的吸附指示劑,溶液的pH就要偏低些。
(4)指示劑的離子與加入滴定劑的離子應帶有相反的電荷。並且溶液不能太稀,獲得的沉澱太少會影響終點的觀察。
(5)帶有吸附指示劑的鹵化銀膠體對光線極敏感,遇光易分解析出金屬銀,在滴定過程中應避免強光照射。
3.套用範圍
本法適用於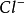 ,
,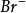 ,
,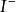 ,
, ,
, ,
,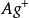 和
和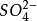 等離子
等離子
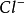
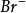
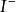


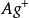
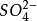
標準溶液的配製與標定
(一)硝酸銀滴定液
1.直接法配製
2.標定用基準氯化鈉標定,可用三種方法中任何一種,以螢光黃指示液指示終點。最佳選擇是用測定方法一致的標定法,消除系統誤差。
3.貯藏置玻璃塞的棕色玻瓶中,密閉保存。
(二)硫氰酸銨滴定液
1.標定法配製,硫氰酸銨溶液吸濕,並且常常含有雜質,只能用標定法。
2.標定用硝酸銀滴定液標定,先配置成近似濃度的溶液,再以硫酸鐵銨指示液進行標定。
其他套用
巴比妥類化合物,在其結構中的亞胺基受兩個羰基影響,上面的H很活潑,能被銀離子置換生成可溶性銀鹽,而它的二銀鹽不溶於水,利用這一性質可進行測定。