由於重水具有滿意的慢化能力和特別高的慢化比,因而它是一種優秀的慢化劑。在其他條件相同的情況下,用重水作慢化劑時逃脫共振吸收機率和熱中子利用因數都比用石墨時高。因此,用重水作慢化劑的非均勻天然鈾反應堆比用石墨作慢化劑的反應堆尺寸小,而所需燃料也少得多。事實上,天然鈾與重水的均勻系統能夠達到臨界,而天然鈾和石墨的均勻混合物則不可能達到臨界。隨著重水生產製備的改進與發展,重水正在得到越來越多的套用。
純氧化氘在3.82℃下熔解而在101.42℃下沸騰,在兩種情況下這些數值都比普通水的相應溫度高了一點點。因此,在採用重水的高溫系統內像採用普通水的系統一樣,也需要很高的壓力。重水密度在室溫下大約是1.10g/cm。
所有天然水都含有大約1/6500(約0.015%)的氧化氘,而重水就是將這種極小份量濃集到所需純度而得到的。曾經採用過好幾種方法來濃集水中的氘,其中有三種方法得到了大規模的工業套用,這就是電解法、蒸餾法和化學交換法。此外,還有一種可能性,就是由液態氫低溫蒸餾分離氘。
製備方法
生產重水的電解法的原理是:當水溶液電解時,即當電流通過水溶液時,陰極上放出的氫氣所含輕同位素的份量比重同位素多些。因此留在電解槽內的水中氘的成分就部分地濃集了。在商業上常用的電解液是鈉或鉀的氫氧化物或碳酸鹽的水溶液;陽極用鎳或鍍鎳的鋼製成,而陰極則由鎳或鋼製成。一個鋼質電解槽可以用來兼作容器和陰極。連續進行電解就有可能得到高純度的重水。但為了取得高濃集程度重水需要大量的電力,因而要採用這種電解方法由普通水開始提取重水,是基本不可行的。不過下面就將看到,當進料水已用其他方法部分濃集以後,電解法卻是特別有價值的方法。
蒸餾法是以輕水與重水蒸汽壓的微小差異為依據的,這一點已經可以由它們在沸點的微小差異上看出。因此,當水被蒸餾時,首先蒸餾出來的液體內含有較高比例的輕同位素,而殘液則含有較多的重同位素。因此,將天然水進行分組蒸餾,就有可能使重水濃集。由於蒸汽壓的差異很小,蒸餾塔內必須包含很大數目的蒸餾盤或等效級。在低壓下蒸餾可以得到最高的分離效率。不管所需的設備要多大,由普通水已經通過分餾得到高純度的重水。超過8級蒸餾以後水內氘的含量就由正常的0.015%升高到大約90%。
化學交換法利用同位素分子化學活潑性上的微小差異進行。雖然同位素具有完全相同的化學性質,但同一元素各種同位素形態或其化合物卻常常具有稍稍不同的反應速率。因此,同位素交換反應的平衡常數,即正逆反應的比速,就與l略有出入。這就使得同位素的局部分離成為可能。
如果所有參加反應的物質都處於汽相下,這一平衡常數的數值範圍約在常溫下的3.4與100℃下的2.6之間。這就意味著假如使含有一些HD的氫氣與水(H2O)蒸氣達成平衡,則反應結果就會生成HDO。可以用普通水將HDO由汽相中洗出,因而水內的氘就被濃集了。
由於水與氫之間的同位素交換平衡建立得很緩慢,甚至在l00℃下也如此,因此有必要使用催化劑。催化劑可以是散布在木碳底子上的鉑粉,也可以是鎳與三氧化二鉻的混合物。將水蒸汽與氫的混合氣流通過催化劑上面,然後用液態水洗出所生成的HDO。將後者蒸發並再與氫氣同時送過催化劑上,這就會生成更多的HDO,如此繼續下去。如果在一個對流級聯繫統內重複進行催化交換反應以及水蒸汽與洗滌水的平衡反應,那么就可以得到相當濃集了氘的水。
氫-水交換法要求有巨大容積的氫氣,因而最經濟的辦法是使它與以氫為重要反應物的另一過程聯繫起來。氨的氮與氫合成製造法滿足這一要求。氫氣先被引入氘的濃集車間,在這裡有一定比例的氘含量在交換較輕同位素時被取走;剩下的氣體於是通到氨的合成車間,對後者而言氣體成分的稍微改變影響不大。
以前也曾經採用一種修正的化學交換原理,叫做“雙溫度法”。它所利用的是兩種溫度下交換反應平衡常數的差異,這種方法不需要大量的氫(或其他氣體),因為氫只用作氘的載體。
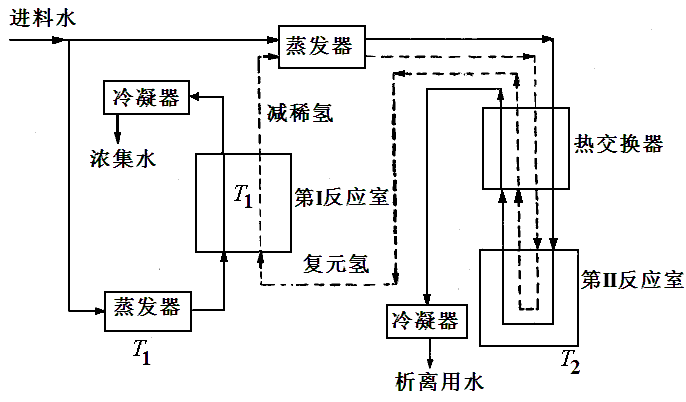 雙溫度法流程圖
雙溫度法流程圖由左方送入的進料水被分為兩部分:一部分在相當低溫度T1下蒸發然後送入第I反應器並與氫氣發生作用。由於發生同位素交換反應的結果,水就被氘所濃集,而氫氣內的這種同位素則減稀。另一部分進料水在高於T1的溫度下蒸發,並與由第I室來的減稀氫氣溫合。當混合氣體通過熱交換器使溫度升高到T2以後(T2比T1高得多),就進入了第II反應室。由於在T2溫度下的水-氫交換反應的平衡常數比T1溫度下要小,因而氘在這時就由水進入減稀氫。在用冷凝法除去水分後,含氘量已經恢復原狀的氫氣又回到第I反應室內,在那裡它又再一次被減稀,這樣循環不已。
如果考慮將重水由0.015%濃集到99.75%(這是套用在反應堆內所必須的)的問題,似乎上述方法中沒有哪一種在全部濃度範圍上比另一種更為優越。濃集過程的成本大部分都花費在開始幾級上,這主要是由於必須要有很大的工廠才能處理巨量的水。然而,當重水的比例增大了以後,這一情況就改變了。其結果就使得開始各級通常不能用的電解方法,在濃集的最後幾級就可以很好地利用了。因此,最經濟的解決辦法就是利用蒸餾或化學交換法,或者兩者合用,來由普通水內將氘含量濃集到某種程度,然後再用電解法使產品提高到所需的濃度。
還有必要提一下在低溫下用液態氫分餾法分離氘的可能性,根據某些資料顯示這種方法應該可能生產出比以上方法更為廉價的重水。雖然液態氫與液態氘在大氣壓下沸點相差僅僅3.12℃,但在一定溫度下它們的蒸汽壓之比卻特別大。這樣,在大約22K溫度下,這一溫度在兩種純粹液體沸點之間,蒸汽壓之比在H2/HD為1.6,而在H2/D2則差不多是2.5。這樣高的相對揮發性意味著利用分餾法有可能獲得很高的分離效率。
這種方法的主要問題在於:(1)大規模的工廠需要在-250℃左右的低溫下運行,這是進行氫的液化和精餾所必需的;(2)在這種低溫下氫記憶體在的微量雜質會在進料管道內生成固態沉積物;(3)大量液態氫的操作所帶來的危險。
 雙溫度法流程圖
雙溫度法流程圖 雙溫度法流程圖
雙溫度法流程圖