基本介紹
- 中文名:配離子
- 外文名:coordination ion / complexion
- 存在:配位化合物晶體、溶液等
- 電荷數:中心離子和配位體電荷數的代數和
概念
配離子的電荷數
定義
舉例
套用
組成
配體
中心原子

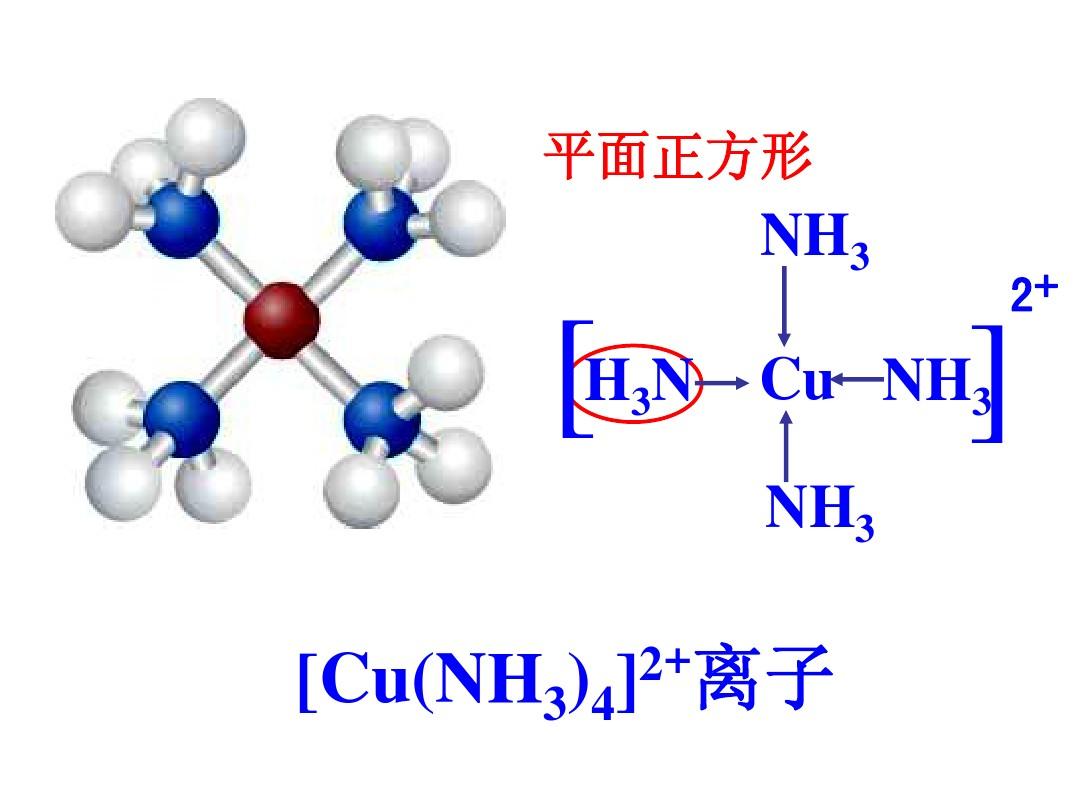

配位化合物的中心離子與配位體鍵合形成的具有一定空間構型和特性的複雜離子(或化學質點)即配合物的內界。...
中心原子與配體以配位鍵結合形成配位化合物的內界,內界一般帶電荷,帶電荷的內界也稱配離子,配離子與帶相反電荷的離子(外界)結合形成配位化合物。配離子可帶正...
緩衝體系中帶相反電荷的離子。如磷酸鈉緩衝液中帶負電荷的磷酸根與帶正電荷的鈉離子互為配對離子;離子交換層析流動相(緩衝液)中與固定相(離子交換樹脂)本身所帶電...
絡離子(Complex Ion)即配離子,由一個以上的中心原子通過配位鍵與H2O、NH3等中性分子或CN-、Cl-等陰離子形成的複雜離子稱為絡離子,如鐵氰根離子[Fe(CN)6]3-...
陽離子和陰離子(通常為配離子通過靜電吸引力結合形成的電中性化合物,稱為離子締合物。...
為一類具有特徵化學結構的化合物,由中心原子(或離子,統稱中心原子)和圍繞它的分子或離子(稱為配位體/配體)完全或部分通過配位鍵結合而形成。包含由中心原子或離子...
配位體是配位化合物(或絡合物)中的中心元素相結合的陰離子或中性分子,如含有孤對電子的鹵素元素、氨。用銨根離子(NH+4)來說明的話,氨(NH3)和氫離子(H+)配...
在含鈾晶體配合物中,鈾大多數是以鈾醯離子,(UO22+)的形式存在的,鈾醯離子可以與多種原子配位,如O, N,S,Cl,I等。鈾醯離子中兩個配位位置被UO22+中的...
配位原子指的是配位化合物中直接和中心原子(或離子)配位的配位體的原子。配位原子提供弧對電子被中心離子接受形成配位鍵。例F、I、Br等電負性較大的非金屬...
該物質的中心原子是鐵離子(Fe3+),配位體是氰根離子(CN-),配位數為6,內界是鐵氰根離子{[Fe(CN)6]3-},外界是鉀離子(K+)。...
Hg2+形成配合物的傾向較小。而Hg2+易和Cl-、Br-、 I-、CN-、 SCN-等形成穩定的配離子,配位數一般為2或4,配位數為4的配合物為四面體構型。...
金屬原子或離子與含有兩個或兩個以上配位原子的配位體作用,生成具有環狀結構的絡合物,該絡合物叫做螯合物。能生成螯合物的這種配體物質叫螯合劑,也稱為絡合劑。...
配位異構(oordination isomerism)是指配位化合物中陽離子和陰離子兩者都是配離子時,兩個配離子之間交換配體而產生的異構現象。...
6.3 影響配離子電對的標準還原電勢的其他因素 6.4 非常氧化態的穩定性 第七章 簇狀配合物 7.1 M-M鍵與簇狀配合物 7.2 簇狀配合物的分類 7.3 簇狀配合...
不帶電荷的中性配位個體也稱配位分子,它本身就是配合物。帶電荷的配位個體稱為配離子,其中帶正電荷的配位個體稱為配陽離子;帶負電荷的配離子稱為配陰離子。...
配離子[Pt(C2H4)Cl3]的構型是平面四邊形(圖21-8,圖21-9)。二氯化鈀:把金屬鈀直接氯化得二氯化鈀PdCl2,823K以上得不穩定的α-PdCl2,823K以下轉變為β-...
它是以配位反應為基礎的一種滴定分析法。可用於對金屬離子進行測定。若採用EDTA(乙二胺四乙酸)作配位劑測定金屬原子,其反應可表示為Mn++Y4-===MYn-4,式中...
鈾配合物是一門學科,由一個正離子和一定數目的負離子或中性分子以配位鍵方式所組成,並帶有正電荷或負電荷的複雜離子,稱為配合離子。...
八面體構型配合物是配位數為6的配離子構型為正八面體的配合物。配體通過配位鍵與中心離子連線,分別位於中心離子的上下、前後、左右,最終的配體結構為正八面體。...
螯合物具有環狀結構的配合物,是通過兩個或多個配位體與同一金屬離子形成螯合環的螯合作用而得到,螯合物中的配位體稱為螯合配體(chelating ligand)、螯合基團(...
