胺的還原烷基化是指以伯胺(或仲胺)代替氨與羰基化合物作用後再經氫化生成仲胺(或叔胺)的反應過程。例如,使用甲醛對脂肪胺和芳胺類化合物逃行甲基化反應,是一個方便可行的好方法。
胺的還原烷基化實際上也是縮合氫化的一個重要方面,它的套用比較廣泛。
基本介紹
- 中文名:還原烷基化
- 外文名:reductive alkylation
- 影響因素:羰基活性、氨基的鹼性
- 套用學科:有機化學
簡介
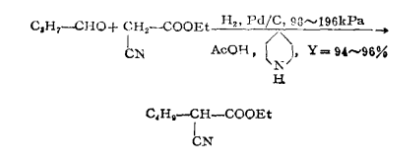 反應方程式
反應方程式影響因素
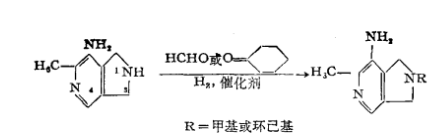 反應方程式
反應方程式催化劑
相關擴展
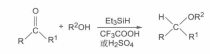 反應方程式
反應方程式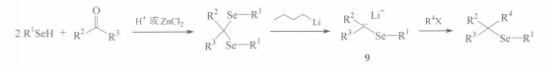 反應方程式
反應方程式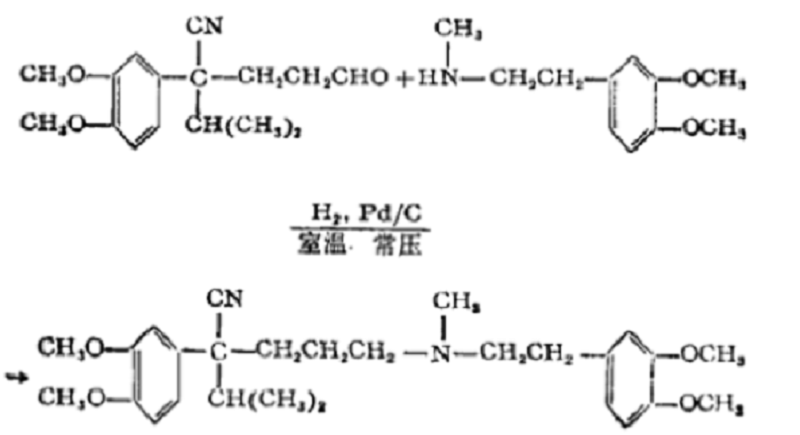
胺的還原烷基化是指以伯胺(或仲胺)代替氨與羰基化合物作用後再經氫化生成仲胺(或叔胺)的反應過程。例如,使用甲醛對脂肪胺和芳胺類化合物逃行甲基化反應,是一個方便可行的好方法。
胺的還原烷基化實際上也是縮合氫化的一個重要方面,它的套用比較廣泛。
 反應方程式
反應方程式 反應方程式
反應方程式 反應方程式
反應方程式 反應方程式
反應方程式胺的還原烷基化是指以伯胺(或仲胺)代替氨與羰基化合物作用後再經氫化生成仲胺(或叔胺)的反應過程。例如,使用甲醛對脂肪胺和芳胺類化合物逃行甲基化反應,是一...
Clark-Eschweiler胺的還原烷基化反應,伯胺或仲胺用甲醛和甲酸進行還原甲基化的反應。甲基作為還原劑是氫的供體。胺是氨的氫原子被烴基代替後的有機化合物。氨分子...
N-烷基化指的是氨、脂肪族或芳香族胺類氨基中的氫原子被烷基取代,或者通過直接加成而在氮原子上引入烷基的反應。...
在下圖所示反應中,1,4-二溴丁烷被加入到苯甲酸叔丁酯中,最後生成烷基化的1,4-環己雙烯產物。 [1] 生成1,4-環己雙烯產物 Birch還原反應實例 編輯 ...
在活性染料反應機理,偶氮染料的偶氮體與腙體互變異構,硝基物加氫還原烷基化,絲綢的反應性染整,甲型染料全成等領域中獲得的成果和新論點曾得到國內外同行專家較高的...
Aluminohydrides還原反應227Birch還原229Borch還原胺化反應230Bouveault-Blanc酯還原232Cannizzaro歧化反應233Chan還原反應234Clark-Eschweiler胺的還原烷基化235...
16 6醇的還原烷基化56716 7醇加成到異氰酸酯56716 8腈的醇解56716 9黃原酸鹽的生成56716 2 1 3硫親核試劑56716 10H2S和硫醇加成到羰基化合物上567...
一般步驟是:①先將糖蛋白還原烷基化、脫鹽,加Glu-c酶切,產物再用內切糖苷酶酶切,含糖肽段峰將出現位移。採用差位酶切法對其進行驗證:內切糖苷酶F(...
5 2 4Bouveault Blanc酯還原2615 2 5Breslow遠程氧化脫氫法2625 2 6Cannizzaro歧化反應2625 2 7Clark Eschweiler胺的還原烷基化263 [1] ...
16 6醇的還原烷基化56716 7醇加成到異氰酸酯567 [1] 16 8腈的醇解56716 9黃原酸鹽的生成56716 2 1 3硫親核試劑56716 10H2S和硫醇加成到羰基化合物上...
二、糖苷鍵類型及糖基化位點的測定: 糖基化位點的確定,則必須依賴一系列酶切反應的實現來加以證實。一般步驟是:①先將糖蛋白還原烷基化、脫鹽,加Glu-c酶切,...
往往會加些助劑來加以修飾,如Fe、Sn、Bi、S、V、Cu、K 等,用來提高催化劑的選擇性和使用壽命,而Pt-V/C 載體催化劑套用於鹵代硝基物還原和還原烷基化反應。...
