生物反應中,酶和底物結合時,底物的結構和酶的活動中心的結構十分吻合,就好像一把鑰匙配一把鎖一樣。酶的這種互補形狀,使酶只能與對應的化合物契合,從而排斥了那些形狀、大小不適合的化合物,這就是“鎖鑰學說”,是“誘導契合”學說的前身。
“誘導契合”學說指出,酶並不是事先就以一種與底物互補的形狀存在,而是在受到誘導之後才形成互補的形狀。底物一旦結合上去,就能誘導酶蛋白的構象發生相應的變化,從而使酶和底物契合而形成酶-底物絡合物,並引起底物發生反應。反應結束當產物從酶上脫落下來後,酶的活性中心又恢復了原來的構象。
基本介紹
- 中文名:誘導契合學說
- 外文名:induced fit theory
- 提出者:D.E.Koshland
- 提出時間:1958年
簡介
相關信息
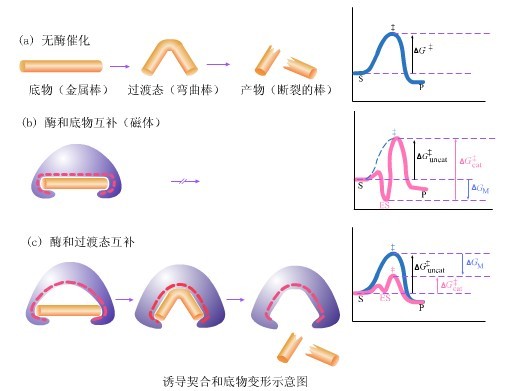 酶-底物變形與契合示意圖
酶-底物變形與契合示意圖
