名稱簡介
在生物分子中有些分子的特定結構部位能夠同其他分子相互識別並結合,如酶與
底物的識別結合、受體與配體的識別結合、抗體與
抗原的識別結合,這種結合既是特異的,又是可逆的, 改變條件可以使這種結合解除。生物分子間的這種結合能力稱為親和力。親和層析就是根據這樣的原理設計的蛋白質
分離純化方法。
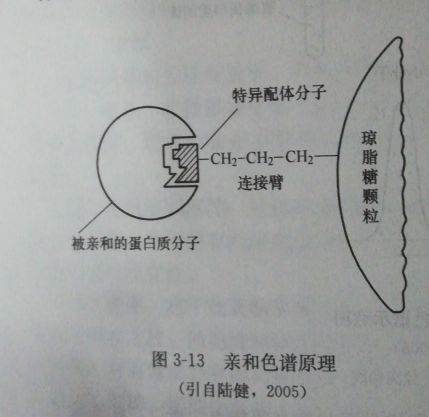
原理介紹
親和層析是一種吸附層析,
抗原(或抗體)和相應的抗體(或抗原)發生特異性結合,而這種結合在一定的條件下又是可逆的。所以將抗原(或抗體)固相化後,就可以使存在液相中的相應抗體(或抗原)選擇性地結合在固相載體上,藉以與液相中的其他蛋白質分開,達到
分離提純的目的。
此法具有高效、快速、簡便等優點。
載體要求
理想的載體應具有下列基本條件:①不溶於水,但高度親水;②惰性物質,非特異性吸附少;③具有相當量的化學基團可供活化;④
理化性質穩定;⑤機械性能好,具有一定的顆粒形式以保持一定的流速;⑥通透性好,最好為多孔的網狀結構,使大分子能自由通過;⑦能抵抗微生物和醇的作用。
瓊脂糖凝膠的優點是親水性強,理化性質穩定,不受細菌和酶的作用,具有疏鬆的網狀結構,在緩衝液離子濃度大於0.05Mol/L時,對蛋白質幾乎沒有非特異性吸附。瓊脂糖凝膠極易被
溴化氫活化,活化後性質穩定,能經受層析的各種條件,如0.1Mol/L NaOH或1Mol/L HCl處理2h~3h及
蛋白質變性劑7Mol/L尿素或6Mol/L
鹽酸胍處理,不引起性質改變,故易於再生和反覆使用。
瓊脂糖凝膠微球的商品名為Sepharose,含糖濃度為2%、4%、6%時分別稱為2B、4B、6B。因為Sepharose 4B的結構比6B疏鬆,而
吸附容量比2B大,所以4B套用最廣。
名詞解釋
親和層析:利用共價連線有特異
配體的層析介質,分離蛋白質混合物中能特異結合配體的目的蛋白質或其他分子的
層析技術