概念
以蛋白質分子的結構規律及其生物功能的關係作為基礎,通過
化學、
物理和
分子生物學的手段進行
基因修飾或
基因合成,對現有蛋白質進行改造,或製造一種新的蛋白質,以滿足人類對生產和生活的需求。
詳解
蛋白質是一切生命活動存在的物質基礎和唯一形式,同時也是診斷疾病、治療疾病的物質基礎或藥物。人類蛋白數量不僅遠超過基因數量,而且由於蛋白質的可變性和多樣性導致了
蛋白質研究技術遠比
核酸技術要複雜和困難的多。因此人類蛋白質構成了後基因組時代最重要的研究內容,具有無限廣闊的研究前景。
蛋白質是
生命的體現者,離開了蛋白質,
生命將不復存在。可是,生物體記憶體在的天然蛋白質,有的往往不盡人意,需要進行改造。由於蛋白質是由許多
胺基酸按一定順序連線而成的,每一種蛋白質有自己獨特的胺基酸順序,所以改變其中關鍵的胺基酸就能改變蛋白質的性質。而胺基酸是由
三聯體密碼決定的,只要改變構成
遺傳密碼的一個或兩個鹼基就能達到改造蛋白質的目的。蛋白質工程的一個重要途徑就是根據人們的需要,對負責編碼某種蛋白質的基因重新進行設計,使合成的蛋白質變得更符合人類的需要。這種通過造成一個或幾個鹼基
定點突變,以達到修飾蛋白質
分子結構目的的技術,稱為基因定點突變技術。
蛋白質工程是在基因重組技術、
生物化學、
分子生物學、
分子遺傳學等學科的基礎之上,融合了
蛋白質晶體學、蛋白質動力學、蛋白質化學和
計算機輔助設計等多學科而發展起來的新興研究領域。其內容主要有兩個方面:根據需要合成具有特定胺基酸序列和空間結構的蛋白質;確定蛋白質化學組成、空間結構與生物功能之間的關係。在此基礎之上,實現從胺基酸序列預測蛋白質的空間結構和生物功能,設計合成具有特定生物功能的全新的蛋白質,這也是蛋白質工程最根本的目標之一。
 《蛋白質工程原理與技術》
《蛋白質工程原理與技術》蛋白質工程尚未有統一的定義。一般認為蛋白質工程就是通過基因重組技術改變或設計合成具有特定生物功能的蛋白質。實際上蛋白質工程包括蛋白質的分離純化,蛋白質結構和功能的分析、設計和預測,通過基因重組或其它手段改造或創造蛋白質。從廣義上來說,蛋白質工程是通過
物理、
化學、
生物和基因重組等技術改造蛋白質或設計合成具有特定功能的新蛋白質。 利用基因工程的手段,在目標蛋白的胺基酸序列上引入突變,從而改變目標蛋白的空間結構,最終達到改善其功能的目的。傳統的蛋白質工程手段大多通過引入隨機突變來改造目標蛋白,隨著計算機技術和
生物信息學技術的飛速發展,計算機模擬被越來越多的套用到蛋白質工程中,從而衍生出半合理化設計,合理化設計等多種新的蛋白質工程的手段。例如國內的尚科生物醫藥上海有限公司通過對蛋白質DNA改組,定向進化對酶進行合理化設計,從而提高酶的活性。
研究內容
1. 蛋白質結構分析
——基礎
2. 結構、功能的設計和預測
——基礎的套用與驗證
3. 創造和/或改造蛋白質——新蛋白質
——終目標
基本途徑
從預期的蛋白質功能出發→設計預期的蛋白質結構→推測應有的胺基酸序列→找到相對應的核糖核苷酸序列(RNA)→找到相對應的
脫氧核糖核苷酸序列(DNA)。
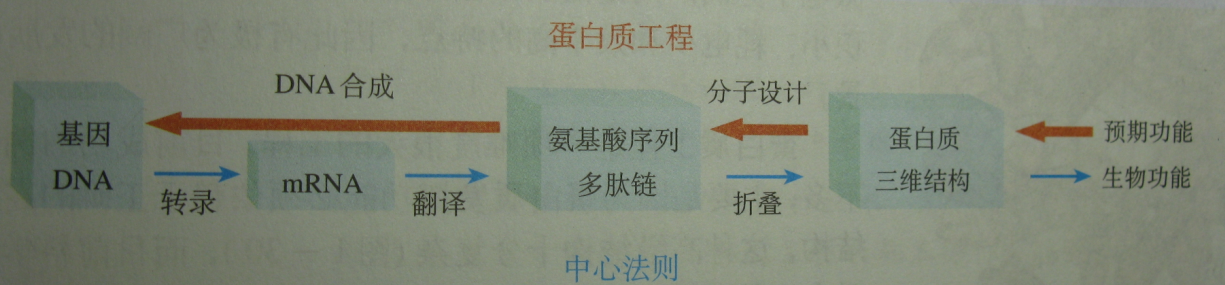 蛋白質工程流程圖
蛋白質工程流程圖蛋白質工程是指以蛋白質分子的結構規律及其與生物功能的關係作為基礎,通過基因修飾或基因合成,對現有蛋白質進行改造,或製造一種新的蛋白質,以滿足人類的生產和生活的需求。也就是說,蛋白質工程是在
基因工程的基礎上,延伸出來的
第二代基因工程,是包含多學科的綜合科技工程領域。
結構分析
蛋白質工程的核心內容之一就是收集大量的蛋白質分子結構的信息,以便建立結構與功能之間關係的資料庫,為蛋白質結構與功能之間關係的理論研究奠定基礎。
三維空間結構的測定是驗證蛋白質設計的假設即證明是新結構改變了原有生物功能的必需手段。晶體學的技術在確定蛋白質結構方面有了很大發展,但是最明顯的不足是需要分離出足夠量的純蛋白質(幾毫克~幾十毫克),製備出
單晶體,然後再進行繁雜的數據收集、計算和分析。
另外,蛋白質的晶體狀態與自然狀態也不盡相同,在分析的時候要考慮到這個問題。
核磁共振技術可以分析液態下的肽鏈結構,這種方法繞過了結晶、X-射線衍射成像分析等難點,直接分析自然狀態下的蛋白質的結構。現代核磁共振技術已經從一維發展到三維,在計算機的輔助下,可以有效地分析並直接模擬出蛋白質的空間結構、蛋白質與輔基和底物結合的情況以及酶催化的動態機理。從某種意義上講,核磁共振可以更有效地分析蛋白質的突變。國外有許多研究機構正在致力於研究蛋白質與核酸、酶抑制劑與蛋白質的結合情況,以開發具有高度專一性的藥用蛋白質。
結構、功能的設計和預測
根據對天然蛋白質結構與功能分析建立起來的資料庫里的數據,可以預測一定胺基酸序列肽鏈空間結構和生物功能;反之也可以根據特定的生物功能,設計蛋白質的胺基酸序列和空間結構。通過基因重組等實驗可以直接考察分析結構與功能之間的關係;也可以通過分子動力學、分子熱力學等,根據能量最低、同一位置不能同時存在兩個原子等基本原則分析計算蛋白質分子的立體結構和生物功能。雖然這方面的工作尚在起步階段,
但可預見將來能建立一套完整的理論來解釋結構與功能之間的關係,用以設計、預測蛋白質的結構和功能。
創造改造
蛋白質的改造,從簡單的物理、化學法到複雜的基因重組等等有多種方法。物理、化學法:對蛋白質進行變性、復性處理,修飾蛋白質側鏈官能團,分割肽鏈,改變表面電荷分布促進蛋白質形成一定的立體構像等等;生物化學法:使用蛋白酶選擇性地分割蛋白質,利用轉糖苷酶、酯酶、醯酶等去除或連線不同化學基團,利用轉醯胺酶使蛋白質發生膠連等等。以上方法只能對相同或相似的基團或化學鍵發生作用,缺乏特異性,不能針對特定的部位起作用。採用基因重組技術或人工合成DNA,不但可以改造蛋白質而且可以實現從頭合成全新的蛋白質。
蛋白質是由不同胺基酸按一定順序通過肽鍵連線而成的肽構成的。胺基酸序列就是
蛋白質的一級結構,它決定著蛋白質的空間結構和生物功能。而胺基酸序列是由合成蛋白質的基因的DNA序列決定的,改變DNA序列就可以改變蛋白質的胺基酸序列,實現蛋白質的可調控生物合成。在確定基因序列或胺基酸序列與蛋白質功能之間關係之前,宜採用隨機誘變,造成鹼基對的缺失、插入或替代,這樣就可以將研究目標限定在一定的區域內,從而大大減少基因分析的長度。一旦目標DNA明確以後,就可以運用定位突變等技術來進行研究。
定位突變蛋白質中的胺基酸是由基因中的三聯密碼決定的,只要改變其中的一個或兩個就可以改變胺基酸。通常是改變某個位置的胺基酸,研究蛋白質結構、穩定性或催化特性。噬菌體M13的生活周期有二個階段,在噬菌體粒子中其
基因組為單鏈,侵入
宿主細胞以後,通過複製以雙鏈形式存在。將待研究的基因插入
載體M13,製得單鏈模板,人工合成一段寡核苷酸(其中含一個或幾個非配對鹼基)作為引物,合成相應的互補鏈,用T4連線酶連線成閉環雙鏈分子。經轉染
大腸桿菌,雙鏈分子在胞內分別複製,因此就得到兩種類型的噬菌斑,含錯配鹼基的就為突變型。再轉入合適的表達系統合成突變型蛋白質。
盒式突變1985年Wells提出的一種基因修飾技術——盒式突變,一次可以在一個位點上產生20種不同胺基酸的突變體,可以對蛋白質分子中重要胺基酸進行“飽和性”分析。利用定位突變在擬改造的胺基酸密碼兩側造成兩個原載體和基因上沒有的內切酶切點,用該內切酶消化基因,再用合成的發生不同變化的雙鏈DNA片段替代被消化的部分。這樣一次處理就可以得到多種突變型基因。
PCR技術
DNA聚合酶鏈式反應是套用最廣泛的
基因擴增技術。以研究基因為模板,用人工合成的寡核苷酸(含有一個或幾個非互補的鹼基)為引物,直接進行基因擴增反應,就會產生突變型基因。分離出突變型基因後,在合適的表達系統中合成突變型蛋白質。這種方法直接、快速和高效。
高突變率技術從大量的野生型背景中篩選出突變型是一項耗時、費力的工作。有兩種新的突變方法具有較高的突變率:①硫代負鏈法:核苷酸間磷酸基的氧被硫替代後修飾物(α-(S)-dCTP)對某些內切酶有耐性,在有引物和(α-(S)-dCTP)存在下合成負鏈,然後用內切酶處理,結果僅在正鏈上產生“缺口”,用核苷酸外切酶III從3`→5`擴大缺口並超過負鏈上錯配的核苷酸,在聚合酶作用下修復正鏈,就可以得到二條鏈均為突變型的基因;②UMP正鏈法:大腸桿菌突變株RZ1032中缺少脲嘧啶糖苷酶和UTP酶,M13在這種
宿主中可以用脲嘧啶(U)替代胸腺嘧啶(T)摻入模板而不被修飾。用這種含U的模板產生的突變雙鏈轉化正常大腸桿菌,結果含U的正鏈被寄主降解,而突變型負鏈保留並複製。
蛋白質融合將編碼一種蛋白質的部分基因移植到另一種蛋白質基因上或將不同蛋白質基因的片段組合在一起,經
基因克隆和表達,產生出新的融合蛋白質。這種方法可以將不同蛋白質的特性集中在一種蛋白質上,顯著地改變蛋白質的特性。現在研究的較多的所謂“嵌合抗體”和“人緣化抗體”等,就是採用的這種方法。
實際套用
提高穩定性
提高蛋白質的穩定性包括以下幾個方面:(1)延長酶的半壽期;(2)提高酶的熱穩定性;(3)延長藥用蛋白的保存期;(4)抵禦由於重要胺基酸氧化引起的活性喪失。
葡萄糖異構酶(GI)在工業上套用廣泛,為提高其熱穩定性,
朱國萍等人在確定第138位甘氨酸(Gly138)為目標胺基酸後,用雙引物法對GI基因進行體外定點誘變,以脯氨酸(Pro138)替代Gly138,含突變體的重組質粒在大腸桿菌中表達,結果突變型GI比野生型的熱半衰期長一倍;最適反應溫度提高10~12℃;酶比活相同。據分析,Pro替代Gly138後,可能由於引入了一個吡咯環,該側鏈剛好能夠填充於Gly138附近的空洞,使蛋白質空間結構更具剛性,從而提高了酶的熱穩定性。
融合蛋白質
腦啡肽(Enk)N端5肽線形結構是與δ型受體結合的基本功能區域,干擾素(IFN)是一種廣譜抗病毒抗腫瘤的
細胞因子。
黎孟楓等人化學合成了EnkN端5肽編碼區,通過一連線3肽編碼區與人α1型IFN基因連線,在大腸桿菌中表達了這一融合蛋白。以體外人結腸腺癌細胞和多形膠質瘤細胞為模型,採用3H-胸腺嘧啶核苷摻入法證明該融合蛋白抑制腫瘤細胞生長的活性顯著高於單純的IFN,通過Naloxone競爭阻斷實驗證明,抑制活性的增高確由Enk導向區介導。
活性改變
通常飯後30~60min,人血液中
胰島素的含量達到高峰,120~180min內恢復到基礎水平。而目前臨床上使用的胰島素製劑注射後120min後才出現高峰且持續180~240min,與人生理狀況不符。實驗表明,胰島素在高濃度(大於10-5mol/L)時以二聚體形式存在,低濃度時(小於10-9mol/L)時主要以單體形式存在。設計速效胰島素原則就是避免胰島素形成聚合體。類胰島素生長因子-I(IGF-I)的結構和性質與胰島素具有高度的同源性和三維結構的相似性,但IGF-I不形成二聚體。IGF-I的B結構域(與胰島素B鏈相對應)中B28-B29胺基酸序列與胰島素B鏈的B28-B29相比,發生顛倒。因此,將胰島素B鏈改為B28Lys-B29Pro,獲得單體速效胰島素。該速效胰島素已通過臨床實驗。
治癌酶改造
癌症的
基因治療分二個方面:藥物作用於癌細胞,特異性地抑制或殺死癌細胞;藥物保護正常細胞免受化學藥物的侵害,可以提高化學治療的劑量。皰症
病毒(HSV)胸腺嘧啶激酶(TK)可以催化胸腺嘧啶和其他結構類似物如GANCICLOVIR和ACYCLOVIR無環鳥苷磷酸化。GANCICLOVIR和ACYCLOVIR缺少3`端羥基,就可以終止DNA的合成,從而殺死癌細胞。HSV-TK催化GANCICLOVIR和ACYCLOVIR的能力可以通過基因突變來提高。從大量的隨機突變中篩選出一種,在酶活性部位附近有6個胺基酸被替換,催化能力分別提高43和20倍。O6-烷基-鳥嘌呤是DNA經烷基化劑(包括化療用亞硝基藥物)處理以後形成的主要誘變劑和細胞毒素,所以這些亞硝基藥物的使用劑量受到限制。O6-烷基-鳥嘌呤-DNA烷基轉移酶O6-Alkylguanine-DNAalkyltransferase(AGT)能夠將鳥嘌呤O6上的烷基去除掉,起到保護作用。通過反向病毒轉染,人類AGT在鼠
骨髓細胞中表達並起到保護作用。通過突變處理,得到一些正突變AGT基因且活性都比野生型的高,經檢查發現一個突變基因中的第139位脯氨酸被丙氨酸替代。
嵌合抗體
免疫球蛋白呈Y型,由二條重鏈和二條輕鏈通過二硫鍵相互連線而構成。每條鏈可分為可變區(N端)和恆定區(C端),抗原的吸附位點在可變區,細胞毒素或其他功能因子的吸附位點在恆定區。每個可變區中有三個部分在胺基酸序列上是高度變化,在三維結構上是處在β摺疊端頭的鬆散結構(CDR),是抗原的結合位點,其餘部分為CDR的支持結構。不同種屬的CDR結構是保守的,這樣就可以通過蛋白質工程對抗體進行改造。
鼠單克隆抗體被人免疫系統排斥,它潛在的治療作用得不到利用。嵌合抗體就是用人抗體的恆定區替代鼠單克隆抗體的恆定區,這樣它的免疫原性就顯著下降。如用於治療直腸結腸腺癌(COLORECTALADENOCARCINOMA)的單克隆抗體Mab17-1A。儘管嵌合抗體還存在著免疫原的問題,但仍有幾種嵌合抗體通過了臨床實驗。所謂人緣化抗體就是將抗原吸附區域嫁接到人抗體上,這樣抗體上的外源肽鏈降低到最小,免疫原性也就最小。但是,僅將CDR轉接到人抗體上,其抗原吸附能力很小,必須帶上幾個框架胺基酸殘基,才能保持原有的吸附力。這樣就存在免疫原性與抗原吸附力之間的矛盾。通過逐個胺基酸替代或計算機模擬分析,可在保持原有吸附力的基礎之上,儘可能地降低免疫原性。第一個臨床上套用的用於治療淋巴肉芽腫病和
風濕性關節炎的人緣化抗體CAMPATH-1H,儘管療效顯著,但仍有半數以上的患者有免疫反應。而其他人緣化抗體如治療脊髓性白血病的ANTI-CD33等,其免疫反應可以忽略不計。
進展
當前,蛋白質工程是發展較好、較快的
分子工程。這是因為在進行蛋白質
分子設計後,已可套用高效的基因工程來進行蛋白的合成。最早的蛋白工程是福什特(Forsht)等在1982—1985年間對酪氨醯—t—RNA合成酶的分子改造工作。他根據XRD(X射線衍射)實測該酶與底物結合部位結構,用定位突變技術改變與底物結合的胺基酸殘基,並用動力學方法測量所得變體酶的活性,深入探討了酶與底物的作用機制。
佩里(Perry)1984年通過將溶菌酶中Ile(3)改成Cys(3),並進一步氧化生成 Cys(3)-Cys(97)二硫鍵,使酶熱穩定性提高,顯著改進了這種食品工業用酶的套用價值。1987年福什特通過將
枯草桿菌蛋白酶分子表面的Asp(99)和Glu(156)改成Lys,而導致了活性中心His(64)質子pKa從7下降到6,使酶在pH=6時的活力提高10倍。工業用酶最佳pH的改變預示可帶來巨大經濟效益。蛋白工程還可對酶的催化活性、底物專一性、抗氧化性、熱變性、鹼變性等加以改變。由此可以看出蛋白工程的威力及其光輝前景。上述各例是通過對關鍵胺基酸殘基的置換與增刪進行蛋白工程的一類方法。另一類是以某個典型的摺疊進行“從頭設計”的方法。1988年
杜邦公司宣布,成功設計併合成了由四段反平行α—螺旋組成為73個氨基殘基的成果。這顯示,按人們預期要求,通過從頭設計以摺疊成新蛋白的目標已是可望又可及了。預測結構的模型法,在奠定
分子生物學基礎時起過重大作用。蛋白的一級結構,包含著關於高級結構的信息這一點已日益明確。結合模型法,通過分子工程來預測高級結構,已成為人們所矚目的問題了。
蛋白質工程匯集了當代分子生物學等學科的一些前沿領域的最新成就,它把核酸與蛋白質結合、蛋白質空間結構與生物功能結合起來研究。蛋白質工程將蛋白質與酶的研究推進到嶄新的時代,為蛋白質和酶在工業、農業和醫藥方面的套用開拓了誘人的前景。蛋白質工程開創了按照人類意願改造、創造符合人類需要的蛋白質的新時期。
前景
蛋白質工程匯集了當代分子生物學等學科的一些前沿領域的最新成就,它把核酸與蛋白質結合、蛋白質空間結構與生物功能結合起來進行研究。蛋白質工程將蛋白質與酶的研究推進到嶄新的階段,為蛋白質和酶在工業、農業和醫藥方面的套用開拓了誘人的前景。蛋白質工程開創了按照人類意願改造、創造符合人類需要的蛋白質的新時代。蛋白質工程取得的進展向人們展示出了誘人的前景。例如,科學家通過對胰島素的改造,已使其成為速效型藥品。如今,生物和材料科學家正積極探索將蛋白質工程套用於微電子方面。用蛋白質工程方法製成的電子組件,具有體積小、耗電少和效率高的特點,因此有極為廣闊的發展前景。
意義
在醫藥、工業、農業、環保等方面套用前景廣泛
對揭示生命現象的本質和生命活動的規律具有重要意義
是蛋白質結構形成和功能表達的關係研究中不可替代的手段
基礎研究、套用開發
 《蛋白質工程原理與技術》
《蛋白質工程原理與技術》 蛋白質工程流程圖
蛋白質工程流程圖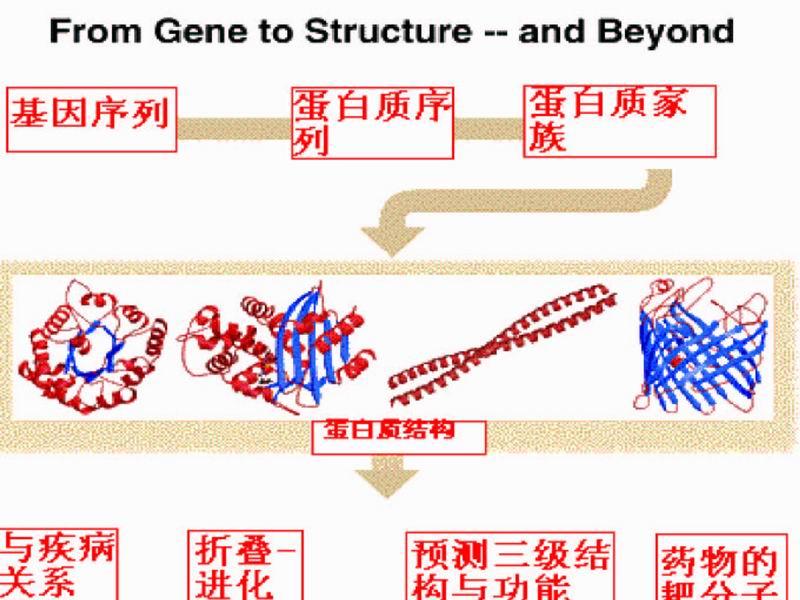
 《蛋白質工程原理與技術》
《蛋白質工程原理與技術》 蛋白質工程流程圖
蛋白質工程流程圖