基本介紹
- 中文名:范德瓦爾方程式
- 外文名:Van Derwal equation
- 提出人:Van der Wals
- 相關:物性常數
- 相關學科:物理·化學
- 類型:方程式
簡介,表達式,闡述,范德瓦爾常數求取,
簡介
在實際氣體的狀態方程式中,范德瓦爾方程式是一個具有重要意義的方程式,它為各種實際氣體狀態方程式確立了一個重要的基礎。
按照理想氣體狀態方程式,定質量氣體等溫變化時pV=常數,但實際氣體僅在壓力較低、溫度較高的情況下近似滿足此關係。試驗證明,氣體的壓力愈高、溫度愈低,這一偏差愈大。因此需要適用於實際氣體的狀態方程式來描述氣體p-v-T之間的關係。
最早的實際氣體狀態方程式是1873年范德瓦爾(Van der Wals)提出的方程式。他針對理想氣體的兩個基本假設,考慮了實際氣體分子本身的體積以及分子之間的引力的影響,對理想氣體狀態方程式引進兩項修正,提出了實際氣體的范德瓦爾方程式。
表達式


范德瓦爾方程式可表示為:

范德瓦爾方程定性地反映了氣體的p-v-T關係,在遠離液態時,即使壓力較高,方程計算值與實驗值誤差也較小。如氮氣常溫下100Mpa時無明顯誤差,但接近液態時誤差較大,如二氧化碳常溫下5Mpa時誤差約4%,100Mpa時誤差35%。而且具有巨大的理論意義,有很多具有重大實用價值的方程都以它為基礎(如R-K方程)。
式中的“物性常數”是與氣體種類有關的正常數,稱為范德瓦爾常數,根據實驗數據予以確認。
闡述
對比理想氣體的狀態方程可知,范德瓦爾考慮到氣體分子具有一定的體積,所以用分子可自由活動的空間Vm-b來取代理想氣體方程中的體積;考慮到氣體分子間的引力作用,氣體對容器壁面所施加的壓力要比理想氣體小,用內壓力修正壓力項。因為由分子間引力引起的分子對器壁撞擊力的減小與單位時間內和單位壁面積碰撞的分子數成正比,同時又與吸引這些分子的其它分子數成正比,因此,內壓力與氣體的密度的平方,即比體積平方的倒數成正比。把范德瓦爾方程和理想氣體狀態方程 作比較可得:摩爾體積Vm越大,兩者之間的差距就越小。而隨著壓力的降低和溫度的升高,比體積變大。因此,當壓力越低而溫度越高時,實際氣體的性質越接近於理想氣體。所以,在溫度遠高於臨界溫度的區域,范德瓦爾方程與實驗結果符合得較好,在臨界區及其附近則有較大誤差。
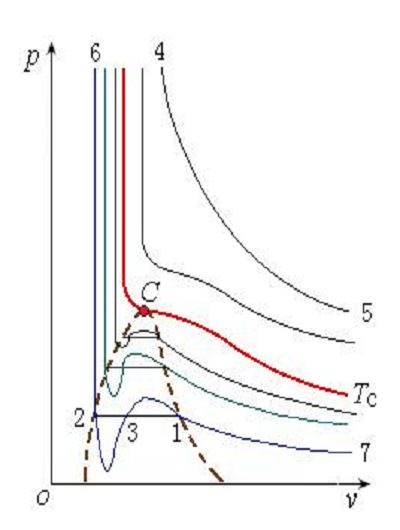
作比較可得:摩爾體積Vm越大,兩者之間的差距就越小。而隨著壓力的降低和溫度的升高,比體積變大。因此,當壓力越低而溫度越高時,實際氣體的性質越接近於理想氣體。所以,在溫度遠高於臨界溫度的區域,范德瓦爾方程與實驗結果符合得較好,在臨界區及其附近則有較大誤差。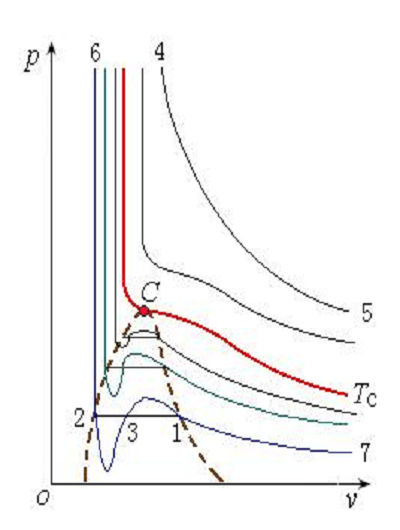 定溫線
定溫線

 定溫線
定溫線范德瓦爾常數求取
氣體的范德瓦爾常數有兩種方法求取,其一:通過氣體壓力、摩爾體積和溫度三種熱力學參數的實驗數據,用曲線擬合法確定;其二:可將臨界壓力和臨界溫度值代入右圖所示的公式中近似計算。左下方圖表列出了一些物質的臨界參數和由實驗數據擬合得出的范德瓦爾常數,供讀者參考。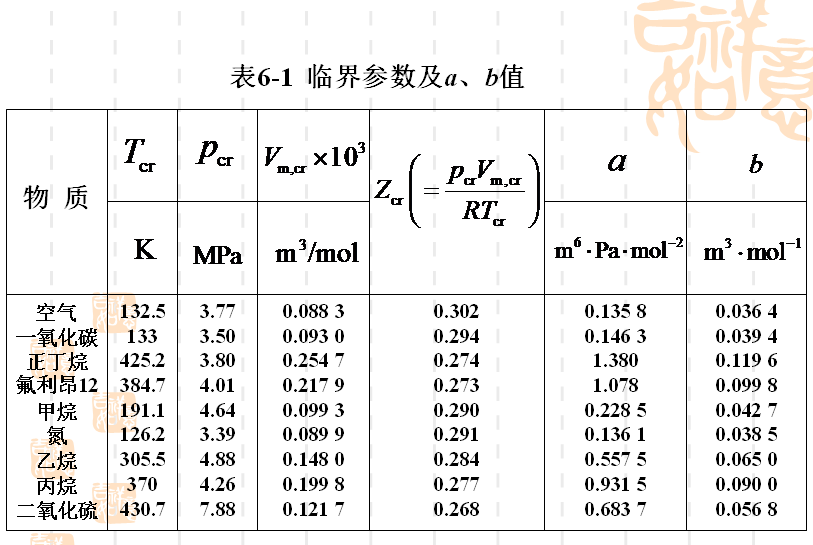 部分常見物質的臨界參數和范德瓦爾常數
部分常見物質的臨界參數和范德瓦爾常數
 部分常見物質的臨界參數和范德瓦爾常數
部分常見物質的臨界參數和范德瓦爾常數范德瓦爾方程是半經驗的狀態方程,它雖然可以較好地定性描述實際氣體的基本特性,但定量計算時不夠精確,故不宜作為精確定量計算的基礎。