分類,分布,理化性質,化學,結構,提取分離,預處理,水法,酸法,鹼法,鹽法,酶法,純化,改性,交聯,與其它高分子共混,生物學性狀,低免疫原性,相容性,可降解性,凝血性,套用,生物醫學材料,組織工程,燒傷,美容,食品,骨骼,飼料,其他,
分類
膠原蛋白是一類蛋白質家族,已至少發現了30餘種膠原蛋白鏈的編碼
基因,可以形成16種以上的膠原蛋白分子,根據其結構,可以分為纖維膠原、基膜膠原、微纖維膠原、錨定膠原、六邊網狀膠原、非纖維膠原、跨膜膠原等。根據它們在體內的分布和功能特點,可以將膠原分成間質膠原、基底膜膠原和細胞外周膠原。間質型膠原蛋白分子占整個機體膠原的絕大部分,包括Ⅰ、Ⅱ、Ⅲ型膠原蛋白分子,Ⅰ型膠原蛋白主要分布於皮膚、肌腱等組織,也是水產品加工廢棄物(皮、骨和鱗)含量最多的蛋白質,占全部膠原蛋白含量的80-90%左右,在醫學上的套用最為廣泛。Ⅰ型膠原在魚類膠原中一個最顯著的的特點是熱穩定性比較低,並呈現有魚種的特異性。Ⅱ型膠原蛋白由軟骨細胞產生;基底膜膠原蛋白通常是指Ⅳ型膠原蛋白,其主要分布於基底膜;細胞外周膠原蛋白通常中指Ⅴ型膠原蛋白,在結締組織中大量存在。按功能,可將膠原分為兩組,第一組是成纖維膠原,包括第Ⅰ、Ⅱ、Ⅲ、Ⅺ、ⅩⅩⅣ和ⅩⅩⅦ型膠原;其餘是第二組,非成纖維膠原。非成纖維膠原的α- 鏈既含有三螺旋域(膠原域,COL),還含有非三螺旋域(非膠原域,NC),其中成纖維膠原約占膠原總數的90%。
膠原蛋白的種類及其在組織中的分布圖冊參考資料。
分布
在水產動物體內膠原蛋白含量高於陸生動物,如鰱魚、鱅魚和草魚魚皮的蛋白質含量分別為25.9%、23.6%和29.8%,均高於各自相應魚肉的蛋白質含量:17.8%、15.3%和16.6%。而魚皮中的膠原含量最高可超過其蛋白質總量的80%,較魚體的其它部位要高許多,有研究報導真鯛魚皮中膠原蛋白占粗蛋白的80.5%,鰻鱺則高達87.3%。如此高的含量意味著得率也高,如小鮪鰹42.5%;日本海鱸40.7%;香魚53.6%;黃海鯛40.1%;竹莢魚43.5%(均以乾重計)。
但膠原蛋白的種類要少得多,已從魚類中分離鑑定出的膠原類型有:廣泛分布在真皮、骨、鱗、鰾、肌肉等處的I型、軟骨和脊索的Ⅱ型和Ⅺ型以及肌肉的V型。而魚皮和魚骨所含的Ⅰ型膠原蛋白是其主要膠原蛋白。此外,還發現ⅩⅧ型膠原,然而哺乳動物中含量比較豐富的Ⅲ型膠原,在水產動物中尚未發現。其中只有Ⅰ型膠原蛋白的價格人們才可以接受;其它類型的膠原如Ⅲ、Ⅳ、Ⅴ等僅在研究中製備,由於價格昂貴都不宜於大量生產。
由於無脊椎動物與脊椎動物在進化上相距遙遠,它們的膠原性質存在明顯的差異。水產無脊椎動物的膠原主要可分為兩類,類Ⅰ型及類Ⅴ型膠原,均相當於脊椎動物的Ⅰ型膠原。
其中類Ⅰ型膠原比較富含有丙氨酸和糖結合型的羥賴氨酸,廣泛的存在於軟體動物的各種器官中,包括:烏賊類的皮和頭蓋軟骨、章魚的皮鮑的肌肉和外套膜等。類Ⅴ型膠原是丙氨酸含量比較少、富含糖結合型羥賴氨酸,已從磯海葵的中膠層、節足動物蝦類和蟹類的肌肉及皮下膜以及原索動物羅氏石勃卒的肌膜體中分離出來。與脊椎動物相比,水產無脊椎動物的膠原顯著難溶,富含於羥賴氨酸,尤其是糖結合型含量多,而且纖維的直徑小於50nm。
有人對海參膠原研究發現,刺參體壁含蛋白 3.3%,其中70%為膠原蛋白。胺基酸分析,膠原富含丙氨酸和羥脯氨酸,但羥賴氨酸含量較少,SDS電泳及SP凝膠柱分析發現其膠原組成為(α1)2α2。還有人從仿刺參(S.japonicus)提取膠原蛋白,利用 EDTA 和 Tris-HCl 浸泡溶漲,用氫氧化鈉除去雜質和非膠原蛋白,採用胃蛋白酶促溶提取粗製膠原,通過鹽析和透析獲取精緻膠原蛋白,並進一步利用 Sephacryl S-300 HR 凝膠過濾和 DEAE-52 陰離子交換除去多糖,獲取膠原蛋白純品。SDS-PAGE 電泳表明膠原分子的組成為 (α1)3,且α鏈類似於脊椎動物Ⅰ型膠原的α1鏈,熱收縮溫度為57℃,低於牛皮膠原5℃。
還有人對采自日本Senzaki 海灣的Stomolopus meleagri水母的外傘組織進行了分析。整箇中膠層被分成三部分,利用醋酸首先將凍乾的水母中膠層分為酸溶性蛋白和酸不溶性物質,利用NaCl溶液將酸溶性蛋白分為酸溶性膠原蛋白和酸溶性非膠原蛋白,而不溶入醋酸的中膠層經胃蛋白酶處理後大多變為可溶性的膠原質。然後利用胺基酸分析儀對分離得到的三部分的組成分別進行分析。發現該水母外傘中膠原蛋白含量很高,大約占乾重的 46.4%。經 SDS 聚丙烯醯胺凝膠電泳分析其膠原蛋白是由三個獨特α 鏈組成,按照它們的移動位置分別分別確定為 α1、α3、α2鏈。
胺基酸分析表明,S.meleagri 水母外傘膠原質中甘氨酸含量最高,每1000個胺基酸殘基含有309個甘氨酸,其次為谷氨酸、脯氨酸和丙氨酸,分別為98、82和82個殘基,羥基脯氨和羥基賴氨酸數也較高,分別為40和27。外傘中高的膠原蛋白含量表明水母資源是一個潛在的膠原蛋白源。
Ⅰ型膠原分子長度約300nm,直徑約1.5nm,呈棒狀,由三條肽鏈組成,其中有兩條α(Ⅰ)鏈,一條
α(Ⅱ)鏈。對機體功能作用最強。α(Ⅰ)鏈和α(Ⅱ)鏈之間的胺基酸序列只有微小的差異。有人利用Ⅰ型膠原蛋白的電腦模型來模擬結締組織的外基質結構,結果表明,用其它一些基團取代Ⅰ型膠原蛋白兩條鏈上氨基乙酸就會導致骨合成異常。第3條α鏈多存在於絕大多數真骨魚類,尤其是魚皮,其他陸生脊椎動物沒有。由3條異種α鏈形成的單一型雜分子α1(Ⅰ)α2(Ⅰ)α3(Ⅰ)組成,而非[α1(Ⅰ)]2α2(Ⅰ)。有人研究了黑石首魚和羊頭海鯛的骨和鱗的酸性膠原蛋白(ASC)的電泳類型,發現在電泳譜帶上可以清楚地看到β、γ、α1和α2組分,且α1的分子量為130 kD,α2的分子量為110 kD。因此,在某些魚類中,與其他組織,如肌肉和膀胱相比較,魚皮膠原蛋白中的α3(Ⅰ)鏈更適宜傳遞。
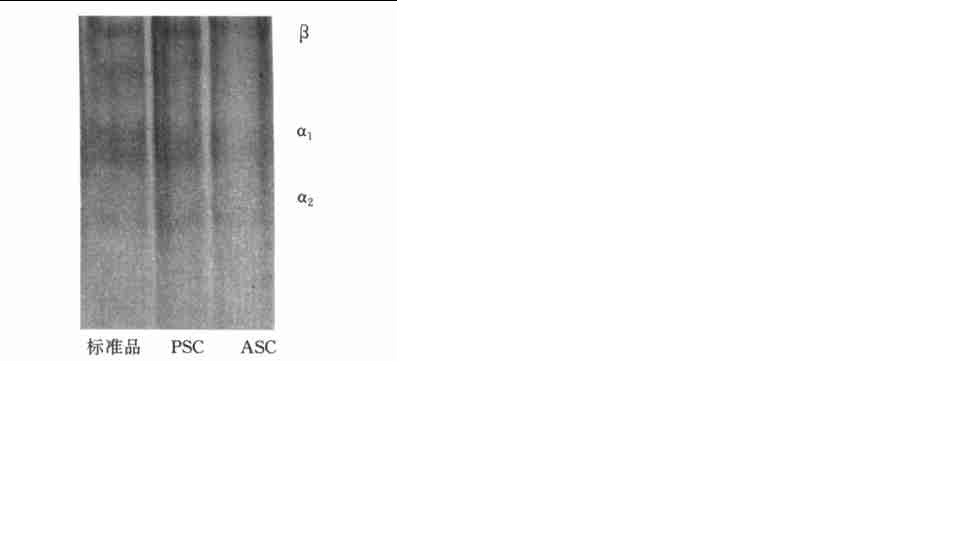 Ⅰ型膠原蛋白的電泳圖譜
Ⅰ型膠原蛋白的電泳圖譜IV型膠原蛋白非常細小而且呈線性分布在組織內部,是連線表皮和真皮的主要要素。Ⅴ型膠原的肽鏈由2 條α1鏈和 1 條α2鏈或由3條α1鏈組成,存在 3 種組裝形式:[α1(Ⅴ)]3、[α1(Ⅴ)]2α2(Ⅴ)和α1(Ⅴ)、α2(Ⅴ)、α3(Ⅴ),其中以[α1(Ⅴ)]2α2(Ⅴ)為主。Ⅴ型膠原分布在細胞周圍以及Ⅰ型膠原的周圍,可能在基膜和結締組織之間起著橋樑作用,已經從數種魚類肌肉中分離出來。XV型膠原蛋白分布較廣而且多分布在血管、神經組織的外圍地帶,而且其與角化細胞腫瘤黑素細胞腫瘤發生有關。
Ⅺ型膠原是異三聚體,其組成為α1 (Ⅺ)α2 (Ⅺ)α3 (Ⅺ),Ⅺ型膠原是軟骨的微量成分,在軟骨膠原纖維的形成和軟骨基質的組成中起著重要作用,且常與Ⅱ型膠原共存。陸生生物的軟骨組織較水生生物含量高的多,所以Ⅱ型膠原的研究的對象大多是陸生生物,雖然在1984 年已經從鯊魚的軟骨中分離出來Ⅱ型膠原,但是從水產動物提取Ⅱ型膠原的研究並不多。
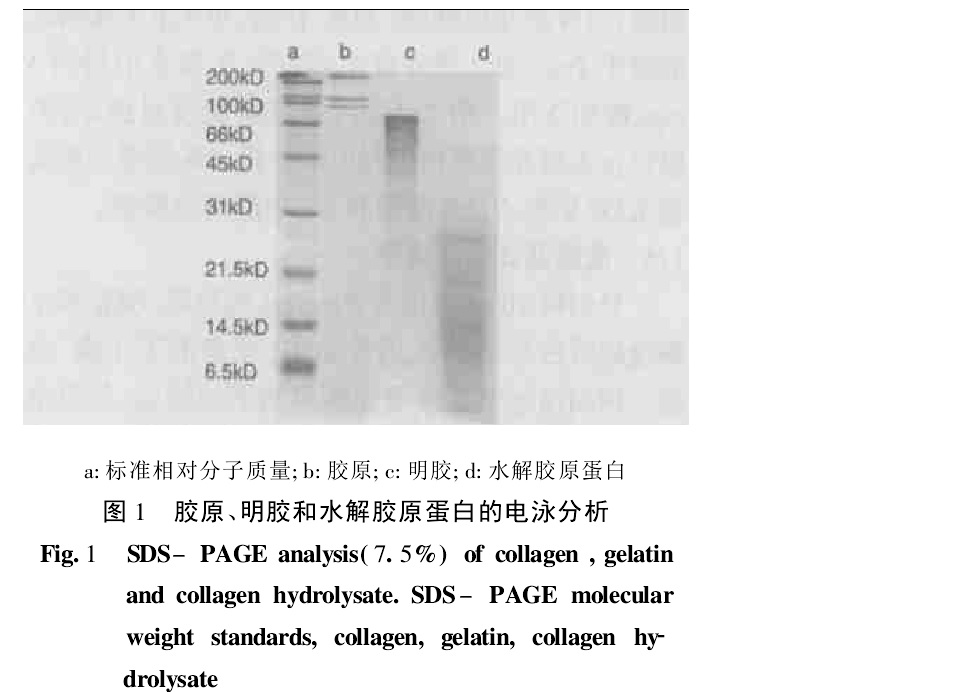 膠原、明膠和水解膠原蛋白的電泳分析
膠原、明膠和水解膠原蛋白的電泳分析ⅩⅧ型膠原發現的相對較晚,同源性較高,還有不同的亞類,主要存在於肺、肝臟和腎臟等組織中。屬於被稱之為multi-plexin的特殊膠原亞族,含有其他膠原所沒有的C末端非三螺旋區(non-triple-heli-cal regions,NC1),這一特殊結構使其與其他僅由三螺旋結構組成的膠原相比擁有更好的靈活性。ⅩⅧ型膠原的研究主要集中在醫學和分子生物學領域,如胚胎中的轉錄表達。
理化性質
化學
一般是白色、透明的粉狀物,分子呈細長的棒狀,相對分子質量從約2kD至300kD不等。膠原蛋白具有很強的延伸力,不溶於冷水、稀酸、稀鹼溶液,具有良好的保水性和乳化性。膠原蛋白不易被一般的蛋白酶水解,但能被動物膠原酶斷裂,斷裂的碎片自動變性,可被普通蛋白酶水解。當環境pH低於中性時,膠原的變性溫度為40~41℃,當環境pH為酸性時,膠原的變性溫度為38~39℃。
膠原蛋白紅外光譜圖冊參考資料。
膠原蛋白是一種兩性電解質,這取決於兩個因素,其一,膠原每個肽鏈具有許多酸性或鹼性的側基;其二,每個肽鏈的兩端有α-羧基和α-氨基,都具有接受或給予質子的能力,它們可在特定的pH值範圍內,解離產生正電荷或負電荷,換句話說,隨著介質的pH值,不同膠原即成為帶有許多正電荷或負電荷的離子。膠原肽鏈側基的pKa值與其組成胺基酸側基的pKa值略有不同,這是由於在蛋白質分子中受到鄰近電荷的影響所造成的。等電點是7.5~7.8,呈現出偏鹼性,因為膠原的肽鏈中鹼性胺基酸比酸性胺基酸多一點。由於是高分子,在水溶液中具有膠體性質和一定粘度,粘度在等電點時最低,而且溫度越低,粘度越大。
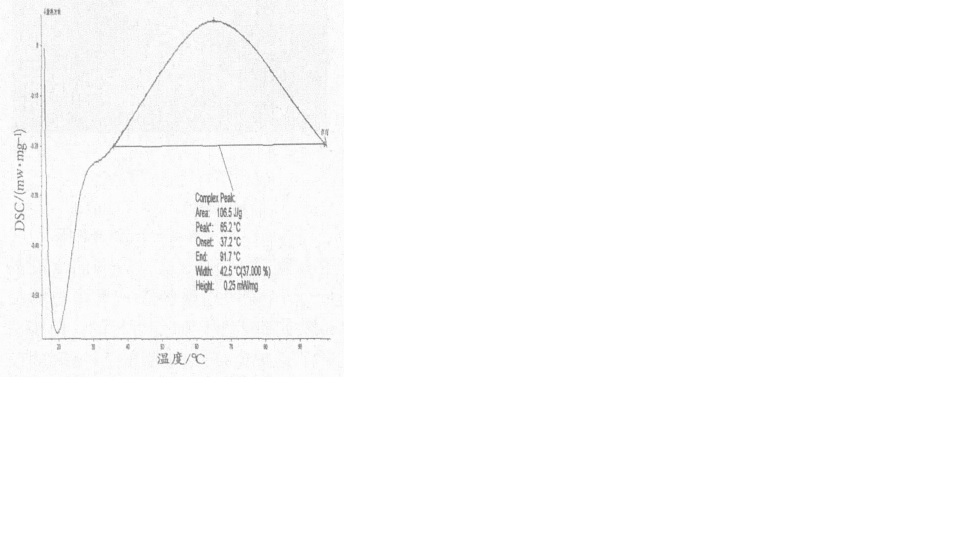 膠原蛋白DSC圖譜
膠原蛋白DSC圖譜不同分子量分布膠原蛋白溶液的黏度與溶質濃度、溶劑、pH、溫度和外加電解質有關。在等電點時膠原蛋白溶液的黏度最低,pH值低於或高於等電點時,膠原蛋白及多肽均將帶一定電荷,溶液的黏度相應增大,離等電點越遠,溶液的黏度越大;不同分子量分布膠原蛋白及多肽溶液的黏度均隨溫度升高而下降。膠原蛋白分子量越大,濃度越大,溶液的黏度越高,高分子量膠原蛋白溶液的黏度隨濃度增加呈指數上升,而低分子量膠原蛋白溶液的黏度則隨濃度增加近似直線上升;在膠原蛋白及多肽溶液中加入電解質會導致其黏度明顯上升。
 豬皮膠原蛋白電泳圖譜
豬皮膠原蛋白電泳圖譜膠原蛋白的水解產物含有多種胺基酸,其中以甘氨酸最為豐富。其次為丙氨酸、谷氨酸和精氨酸,半胱氨酸、色氨酸、酪氨酸以及蛋氨酸等必需胺基酸含量低,因此,膠原蛋白屬不完全蛋白質。水解豬皮膠原所得的肽類產物中含有19種胺基酸,其中包括7種成人必需胺基酸和2種幼兒必需的半必需胺基酸;而且胺基酸總量高達90%以上。在八種人體必需胺基酸中含有六種:異亮氨酸(Ile)為1.21%,亮氨酸(Leu)和苯丙氨酸(Phe)為4.89%,纈氨酸(Val)2.95%,蘇氨酸(Thr)為1.95%,賴氨酸(Lys)為1.94%。
膠原的相對分子質量大,電泳圖有3條泳帶,在100kD附近出現的2條泳帶分別是膠原分子的α1鏈和α2鏈,在200 kD附近出現的1條泳帶是膠原分子的β鏈。即膠原的每條多肽鏈相對分子質量可達100kD,1個膠原分子相對分子質量為300kD。多肽分子量的測定方法常用SDS-PAGE,凝膠色譜法以及質譜法。有人採用凝膠過濾色譜法測定脫鉻革屑中膠原水解產物分子量分布在16.1KD左右。飛行時間質譜法測定比目魚皮膠原寡肽分子量的分布主要集中在0.6~1.8kD。動物蛋白酶水解後的膠原多肽的分子量在2~7kD,比植物蛋白酶水解的膠原多肽分子量範圍更廣。
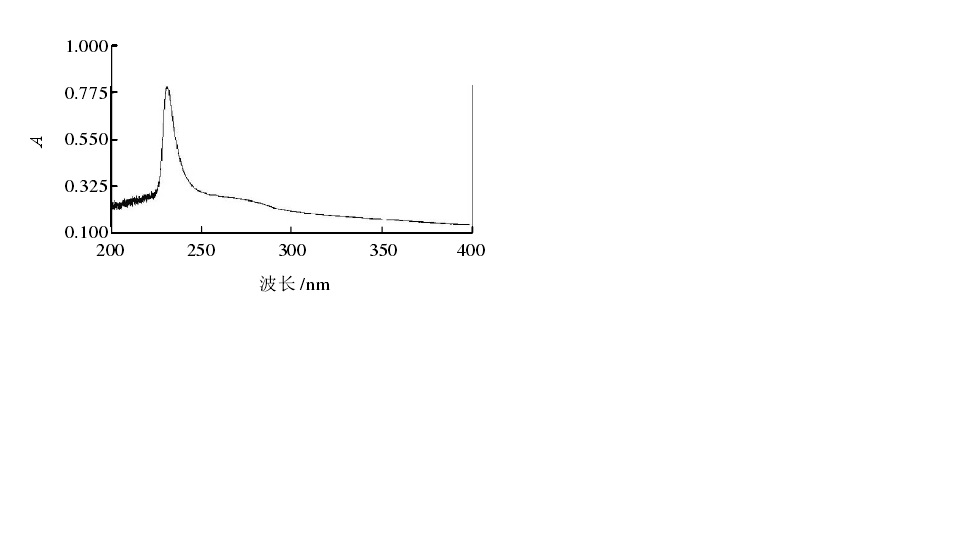 膠原蛋白紫外光譜分析
膠原蛋白紫外光譜分析膠原的熱穩定性是指測定其在水系中纖維的熱收縮溫度(Ts),或溶液中分子的熱變性溫度(Td)。Ts和Td之差一般在20~25℃,而 Ts值較Td值容易測定。Td還可以表示膠原螺旋被破壞的溫度,另外還與其亞胺基酸(脯氨酸和羥脯氨酸)的含量有關,尤其是羥脯氨酸含量,它們之間存在正相關,冷水性魚類的羥脯氨酸含量最低,所以冷水性魚類膠原蛋白Td值明顯低於暖水性魚類,而又都低於陸生動物。但魚皮膠原蛋白與魚肉膠原蛋白相比,其真皮的Td要比肌肉的低1℃左右,這與肌肉膠原中脯氨酸的羥基化率較真皮膠原高有關。有人測定了多種魚皮可溶性膠原蛋白的胺基酸組成,並與牛皮的胺基酸組成進行了比較,發現魚皮膠原蛋白的羥脯氨酸和脯氨酸等亞氨酸含量比牛皮的低。此外,魚皮明膠與牛皮明膠相比,其固有的粘度、熱變性溫度均比較低。
 中性環境中魚鱗膠原蛋白的AFM圖像
中性環境中魚鱗膠原蛋白的AFM圖像膠原蛋白的熱變性溫度可以通過測定膠原蛋白溶液增比黏度的變化來確定。其方法是將膠原蛋白樣品溶於一定量的緩衝溶液中,並配製成一定濃度的溶液,然後用烏式黏度計測量溶液在一定溫度區間內保持一定時間後的增比黏度,以增比黏度對溫度作圖,當增比黏度變化50%時所對應的溫度即為熱變性溫度。熱變性溫度還可通過拉曼光譜和差示掃描量熱法等進行測定。有人測得鱸魚、鯽魚和鱅魚魚皮膠原蛋白的熱變性溫度分別為 25、27和30℃,它們的棲息水溫分別為 26~27、29 和32℃,亞胺基酸含量分別為17.2%、18.1%和 18.6%,與 3 種魚皮膠原的熱變性溫度相吻合Ⅱ型膠原和Ⅺ型膠原Ⅱ型膠原由三條α1肽鏈組成,即[α1(Ⅱ) ]3,富含羥賴氨酸,並且糖化率高,含糖量可達 4%,是軟骨中的主要膠原。另外,即使同一生物,皮和骨膠原蛋白的熱變形溫度也可能不一,像來自日本海鱸、鮐魚、大頭鯊和眼斑魨的皮膠原蛋白的變性溫度為25.0~26.5℃,而骨膠原蛋白的變性溫度則為29.5~30.0℃。附帶結論是骨膠原蛋白的變性溫度範圍整體上比皮膠原蛋白的變性溫度範圍要高。而且骨膠原蛋白和皮膠原蛋白在不同pH時的溶解度不同。這表明皮和骨膠原蛋白的分子特性和構型存在差異。
作為生物高分子,膠原的強度不大,有研究表明膠原蛋白的凝膠強度與其濃度的平方幾乎成正比關係,強度測定可用凝膠強度計。
特別提示:明膠、膠原蛋白和水解膠原蛋白並不相同。明膠是膠原在高溫作用下的變性產物,其組成複雜,相對分子質量分布寬,由於高溫造成膠原蛋白變性,膠原分子的3股螺旋結構被破壞,但可能有部分α鏈的螺旋鏈還存在,因此一定濃度的明膠溶液能成凝膠狀。在食品工業、攝影和製藥業中被廣泛套用。據報導,全世界每年生產的明膠產品中,有65%用於食品工業,20%用於照相工業,10%用於製藥工業。水解膠原蛋白是在較高溫度下用蛋白酶水解膠原或明膠得到的,受溫度和酶的雙重作用,使水解膠原蛋白的相對分子質量比明膠更小,由於在較高溫度條件下,蛋白酶對膠原肽鍵的水解是隨機的,使水解得到的蛋白液組成也很複雜,是相對分子質量從幾千到幾萬的蛋白多肽的混合物。由於分子量小,水解膠原蛋白容易降解,所以在營養保健品和日用化學品開發方面擁有一定的市場。水解膠原蛋白可用於生物發酵培養基,也可以作為一種高蛋白飼料營養添加劑替代進口魚粉用於混、配合飼料生產。膠原、明膠和水解膠原蛋白這3種物質雖具有同源性,但在結構和性能上卻有很大的區別。膠原保留特有的天然螺旋結構,在某些方面表現出明顯優於明膠和水解膠原蛋白的性能,如膠原止血海綿止血性能優於明膠海綿,作為澄清劑用的魚膠原如果變性則沉降能力明顯降低。然而,人們對這3種物質的認識常常產生混淆,認為它們具有相同性質,甚至認為它們是同一種物質。
水解膠原蛋白和膠原多肽也並不相同,可以近似認為是巨觀和微觀的關係。膠原蛋白分子經水解後主要形成相對分子量較小的膠原多肽,由於膠原蛋白獨特的三股超螺旋結構,性質十分穩定,一般的加工溫度及短時間加熱都不能使其分解,從而造成其消化吸收較困難,不易被人體充分利用。水解後其吸收利用率可以提高很多,且可以促進食品中的其它蛋白質的吸收。膠原多肽除了肽鏈的兩端含有未縮合的末端羧基和氨基外,在側鏈上還含有Lys的ε-NH2以及Asp和Glu的-COOH。膠原多肽可完全溶解於水(冷水亦可溶解),水溶液低粘度,在60%的高濃度下也有流動性,耐酸鹼性能好,在酸、鹼存在的情況下均無沉澱;耐高溫性能好,200℃加熱亦無沉澱,同時它還具有良好的吸油性、起泡性和吸水性等。
結構
一級結構是蛋白質分子中胺基酸以肽鍵連線的順序,每一種蛋白質分子,都有其特定的胺基酸組成和排列方式,由此就決定了不同的空間結構和功能。蛋白質分子中一級結構關鍵部位胺基酸的改變,會直接影響其功能,這個關鍵部位就是蛋白質分子的活性中心。已發現並確認了不下30種類型的膠原蛋白。
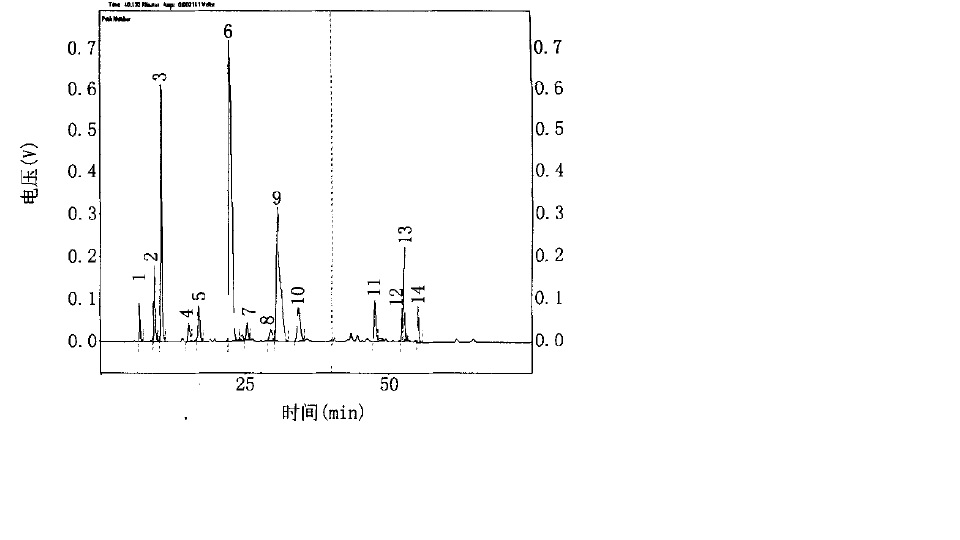 膠原多肽胺基酸組成譜圖
膠原多肽胺基酸組成譜圖一般的蛋白質是雙螺旋結構,而作為細胞外基質(ECM)的一種結構蛋白,膠原蛋白由三條多肽鏈構成三股螺旋結構,或稱膠原域,即3條多肽鏈的每條都左旋形成左手螺旋結構,再以氫鍵相互咬合形成牢固的右手超螺旋結構。膠原特有的左旋a鏈相互纏繞構成膠原的右手複合螺旋結構,這一區段稱為螺旋區段,螺旋區段最大特徵是胺基酸呈現(Gly-X-Y)n 周期性排列,其中 x、Y 位置為脯氨酸(PrO)和羥脯氨酸(Hyp),是膠原蛋白的特有胺基酸,約占25%,是各種蛋白質中含量最高的;膠原蛋白中存在的羥基賴氨酸(Hyl)在其它蛋白質中不存在,它不是以現成的形式參與膠原的生物合成,而是從已經合成的膠原的肽鏈中的脯氨酸(Pro)經羥化酶作用轉化來的。而一般陸生哺乳動物蛋白質中羥脯氨酸和焦谷氨酸的含量極微少。與陸生動物相比,水生動物中的膠原蛋白,其脯氨酸和羥脯氨酸的總量少,而含硫元素的蛋氨酸(Met)含量要遠大於陸生動物中的膠原蛋白。
 酸性環境中魚鱗膠原蛋白的AFM圖像
酸性環境中魚鱗膠原蛋白的AFM圖像一級結構是組成膠原蛋白多肽鏈的胺基酸序列;膠原蛋白分子是由3條左手螺旋(二級結構)的多肽鏈組成,它們相互纏繞形成一個在中心分子軸周圍的右手螺旋(三級結構);完整的膠原蛋白分子的長度約280 nm,直徑約1.5 nm;在Ⅰ型膠原原纖維的二維結構(小角X線衍射圖譜和透射電子顯微照片)中,膠原分子通過一個或多個4 D距離與另一個膠原分子交錯,D表示在小角X線衍射圖譜中所見的基本重複距離,或電子顯微照片中所見的重複距離。因為膠原分子的長度約是4.4 D,膠原分子的交錯引起約有0.4 D的摺疊區和約0.6 D的缺損區。
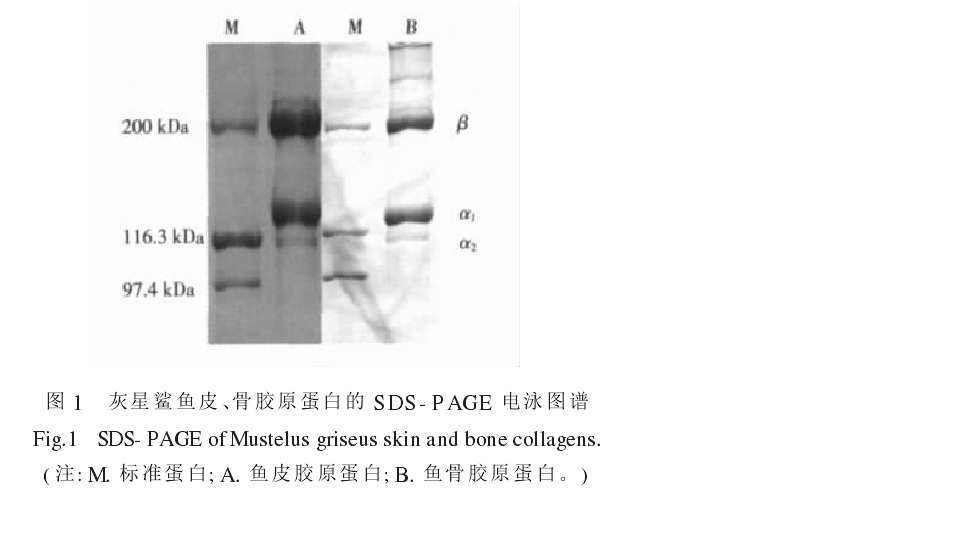 灰星鯊魚皮、骨膠原蛋白的電泳圖譜
灰星鯊魚皮、骨膠原蛋白的電泳圖譜膠原蛋白中甘氨酸(Gly)、丙氨酸(Ala)、脯氨酸(Pro)和谷氨酸(Glu)含量較高,特別是甘氨酸,約占總胺基酸的27%,也有報導說占1/3,即每隔兩個其它胺基酸殘基(X,Y)即有一個甘氨酸,故其肽鏈可用(Gly-X-Y)n 來表示。每個原膠原分子由三條α-肽鏈組成,α-肽鏈自身為α螺旋結構,肽鏈中每三個胺基酸殘基中就有一個要經過此三股螺旋中央區,而此處空間十分狹窄,只有甘氨酸適合於此位置,由此可解釋其胺基酸組成中每隔兩個胺基酸殘基出現一個甘氨酸的特點。特別注意,X、Y均表示任意的胺基酸,只不過X通常是脯氨酸,Y通常指羥脯氨酸。同時還含有少量3-羥脯氨酸(3-hydroxyproline)和5-羥賴氨酸(5-hydroxylysine,Hyl)。羥脯氨酸殘基可通過形成分子內氫鍵穩定膠原蛋白分子。三條α-肽鏈借范德化力、氫鍵及共價交聯則以平行、右手螺旋形式纏繞成“草繩狀”三股螺旋結構,使膠原具有很高的拉伸強度。
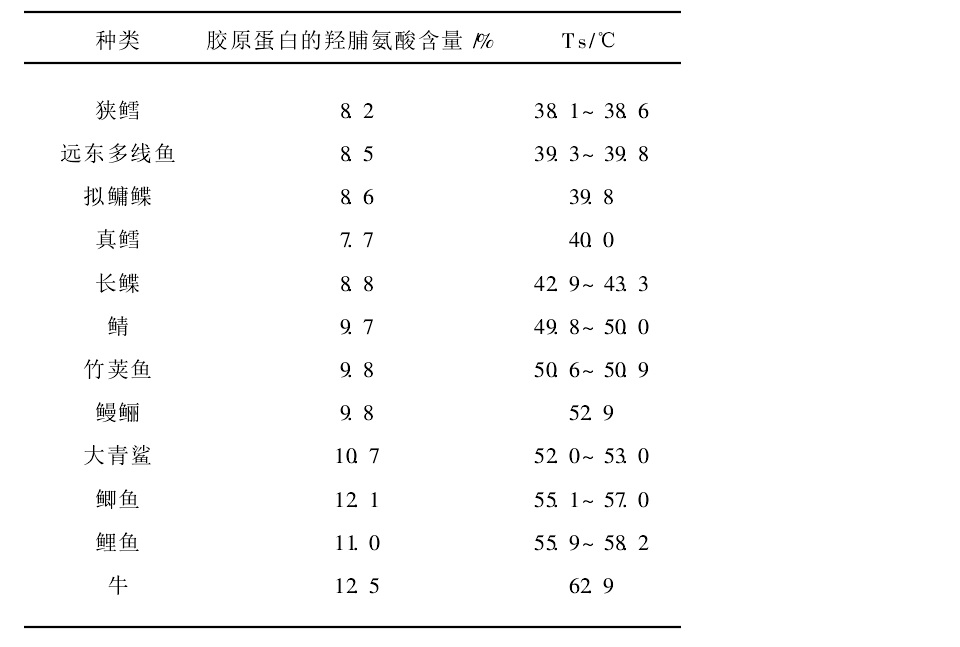 膠原蛋白羥脯氨酸含量和熱收縮溫度
膠原蛋白羥脯氨酸含量和熱收縮溫度提取分離
由於膠原是細胞外間質成分,在體內以不溶性大分子結構存在,並與蛋白多糖、糖蛋白等結合在一起,因此膠原的製備包括材料的選擇、預處理、酸鹼酶鹽水法提取、不同類型膠原的分離和純化。
預處理
除膠原蛋白外,動物骨中還含有油脂、多種礦物質和其他雜質,因此在被用於提取膠原蛋白之前必須進行預處理。先剔除動物骨上殘留的肉質和肌腱等雜物,粉碎後用正丁醇或正己烷萃取出骨油。最後除去骨中無機物以提高膠原蛋白的得率。除去骨中的礦物質可用稀酸或EDTA溶液。有人用原料用5倍質量的1.0moL/LHCL脫鈣處理2d,用正乙烷脫脂後再用胃蛋白酶酶解,在加酶量150U/g,pH值1.7,37℃條件下處理120min,然後在固液比1∶6的情況下抽提5h,在此條件下,提取率可達18%;還有人用EDTA溶液(pH7.4)浸泡骨料5d,可有效脫去骨料中的羥基磷灰石。
膠原蛋白的提取一般有三種方法:一是高壓輔助的物理方法;二是用溶劑預處理結合低溫或熱水抽提的化學方法,根據溶劑的不同,可分為熱水浸提法、酸法、鹼法、鹽法;三是用酶的生物化學法。一般來說,高壓輔助和熱水抽提針對明膠的提取,而低溫抽提和酶法針對膠原的提取,但其基本原理都是根據膠原蛋白的特性改變蛋白質所在的外界環境,把膠原蛋白從其他蛋白質中分離出來。
在實際提取過程中,不同提取方法之間往往相互結合,可以得到較好的提取效果。採用超高壓處理系統對原料給予高壓處理一段時間,使其組織結構和膠原蛋白的三股螺旋結構發生鬆弛、變性,便於分離提取。
水法
熱水提取法是將原料經過除雜蛋白等前處理之後,在一定條件下直接用熱水浸提已經變性了的膠原蛋白或膠原蛋白水解物,使用的溫度有100℃沸水浴、60-70℃、40-45℃。
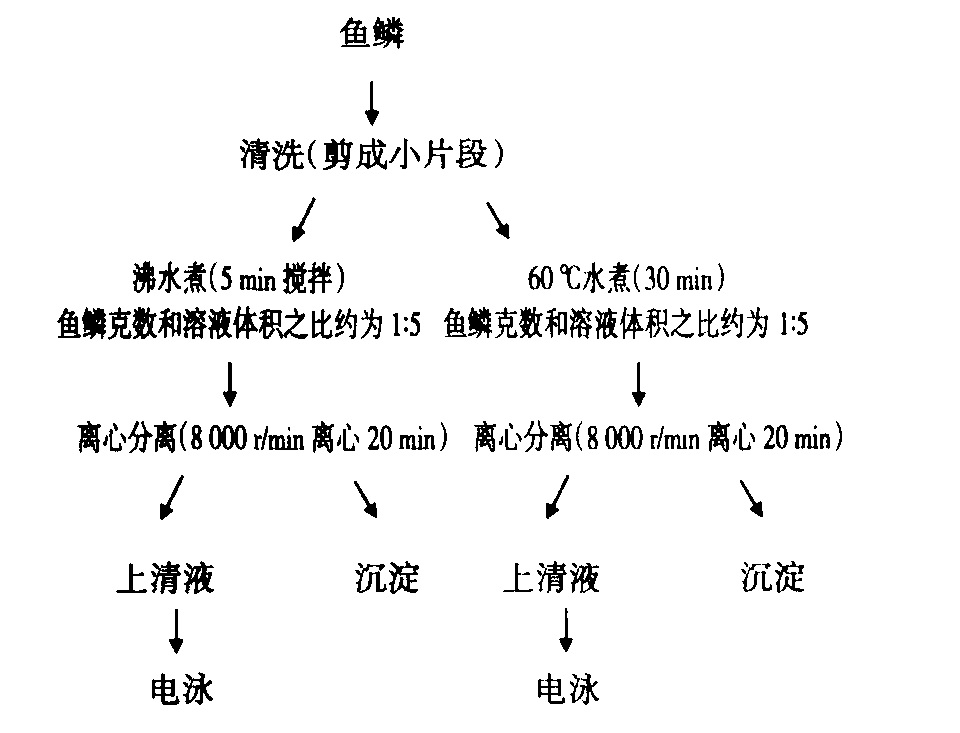 水提取膠原蛋白
水提取膠原蛋白酸法
酸法提取是利用一定濃度的酸溶液在一定的條件下提取膠原蛋白,主要採用低離子濃度酸性條件破壞分子間鹽鍵和希夫鹼,而引起纖維膨脹、溶解,採用酸法提取的膠原蛋白通常成為酸溶性膠原蛋白。酸溶解法可將沒有交聯的膠原分子溶解出來,也可溶解含有醛胺類交聯鍵的膠原纖維,然後釋放到溶劑中。酸法是提取膠原蛋白比較常用和有效的方法,用低溫酸法提取的膠原最大程度的保持了其三螺旋結構,適用於醫用生物材料及原料的製備。通常的做法是將適當濃度的酸液按一定料液比加入到經過預處理的骨粉中,於0~25℃攪拌提取一定時間。在採用酸法進行膠原蛋白的提取時,注意提取溫度不宜過高,以免膠原蛋白的生物活性發生破壞。取樣經前處理後,勻漿在低溫下用酸浸提,離心即可得酸溶性膠原蛋白(acid-soluble collagen,ASC)。作為溶劑使用的酸,主要有鹽酸、磷酸、甲酸、乙酸、蘋果酸、檸檬酸等,但大多數研究集中於乙酸抽提,像Maria Sadowska等用0.5mol/L檸檬酸在室溫下提取骨膠原蛋白,其提取率略低於乙酸提取。檸檬酸因不產生顏色和異味得以廣泛使用於食品工業的膠原蛋白的提取。
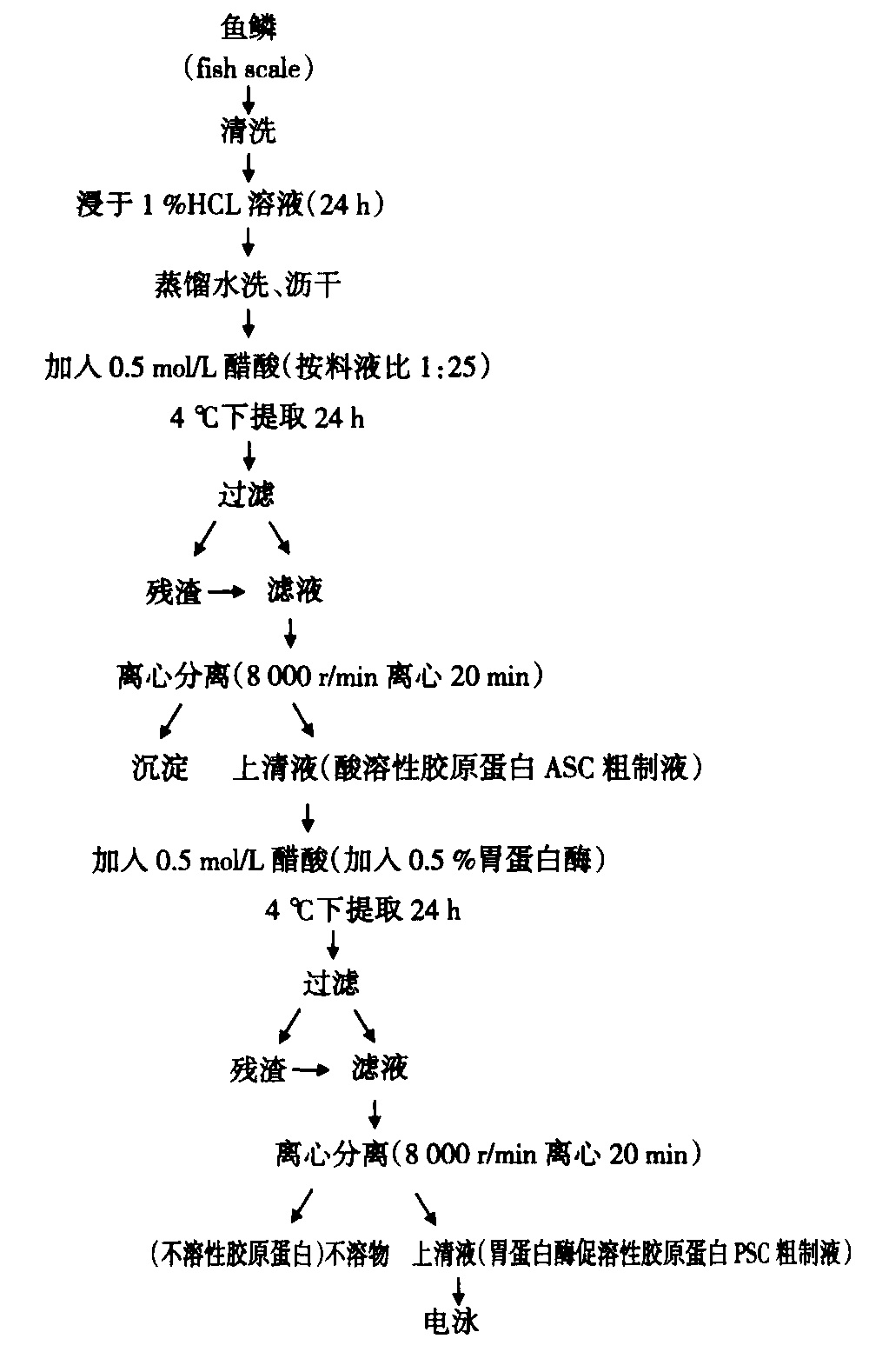 酸提取膠原蛋白
酸提取膠原蛋白酸法處理時,反應強烈,水解徹底,多生成胺基酸混合物,而且使用酸提取時,根據酸濃度、水解溫度、水解時間等條件的不同,可以得到分子量不均的膠原水解物。但是在即使中等濃度酸徹底水解過程中色氨酸也會全部被破壞,絲氨酸和酪氨酸也會部分被破壞,且設備腐蝕嚴重。因此,酸法溶出生物醫用膠原要準確控制酸度、溫度、時間等影響因素。由於各種不足,酸法很少單獨使用,一般和酶法配合。比如以豬皮為原料,在檸檬酸(pH8.6)和胃蛋白酶協同下提取膠原蛋白。在處理後的豬皮中加0.05moL/L含有胃蛋白酶的檸檬酸溶液(pH2.5-3)處理一段時間,然後再用NaCL鹽析,最後提取率為12.35%,提取物保持了完整三股螺旋結構的I型膠原蛋白。還有人以雛雞胸軟骨為原材料,在0.5moL/L醋酸條件下經胃蛋白酶多次消化,在4℃,20000r條件下離心20min,最後套用DEAE-Sephadex A-50進行離子交換層析,之後透析,再用NaCL鹽析,最後得到純化的膠原蛋白Ⅱ型。
鹼法
鹼法提取即利用一定濃度的鹼在一定的外界條件下提取膠原蛋白,鹼處理法中常用的處理劑為石灰、氫氧化鈉、碳酸鈉等,用氫氧化鈉浸提時效果較好。一般的是把樣品勻漿後,用鹼溶液多次溶脹後,再離心提取。但由於易引起蛋白質變性,如膠原肽鍵水解,含羥基、疏基的胺基酸全部被破壞;所得產物等電點pH值較低,天冬酞胺和谷氨酞胺分別轉變為天冬氨酸和谷氨酸,得到的水解產物分子量較在酸性溶液中比低等問題,若比較嚴重的話,還會產生 D、L-型胺基酸消旋混合物,若D型胺基酸含量高過L 型胺基酸,則會抑制L-型胺基酸的吸收,有些D型胺基酸有毒,甚至有致癌、致畸和致突變的作用。而且鹼法提取的含量較低,用氫氧化鈉從魷魚皮中提取鹼溶性膠原蛋白,其得率只有3%(以濕基計)。所以,若想提取結構完整、使用安全的膠原蛋白,很少採用此方法。有關單獨採用鹼法提取膠原蛋白的報導不多,一般是鹼法提取和酸法提法結合使用。比如在4℃條件下,魚骨用0.1moL/L的NaOH浸泡6h,再用2.5%NaCl浸泡6h去除雜蛋白,用10%的異丙醇溶液去除脂肪,0.1moL/L的檸檬酸浸泡3d,最後得到無色無味的膠原蛋白,提取率為11.87%。
 鹼提取膠原蛋白工藝流程
鹼提取膠原蛋白工藝流程注意,無論酸法或鹼法,均可有效地提取膠原蛋白,有人分別採用醋酸- 鹽酸的混合酸液(pH3.0)和NaOH溶液(pH12.0)提取骨膠原蛋白,提取率基本相當。但是,這兩種方法提取膠原蛋白不僅容易影響膠原蛋白的生物活性,而且提取後產生的酸性或鹼性廢液必須進行適當處理,以避免對環境造成污染。
鹽法
鹽法提取是利用各種不同的鹽在不同的濃度條件下提取鹽溶性膠原蛋白的方法。常用來提取膠原的鹽有鹽酸-三羥甲基胺基甲烷(Tris-HCl)、氯化鈉、檸檬酸鹽等。在中性條件下,當鹽的濃度達到一定量時,膠原就會溶解在其中,但是膠原的溶解和分級受中性鹽效應影響,有的鹽可提高膠原的穩定性,而有的則可降低其構象穩定性,從而對提取天然膠原蛋白很不利。此外,可採用不同濃度的氯化鈉對提取的膠原蛋白進行鹽析處理,可以沉澱出不同類型的膠原蛋白。
 膠原蛋白鹽析工藝流程
膠原蛋白鹽析工藝流程酶法
酶法提取是指可溶性膠原和酸溶性膠原被提取後,需用一些蛋白酶,如膠原酶、胃蛋白酶、木瓜蛋白酶和胰凝乳蛋白酶等水解,得到不同的酶促溶性膠原蛋白。所使用的蛋白酶主要分3種:動物蛋白酶(如胰蛋白酶,胃蛋白酶),植物蛋白酶(如木瓜蛋白酶,鳳梨蛋白酶),微生物蛋白酶(如鹼性蛋白酶,中性蛋白酶)。在對酶法水解膠原蛋白的研究中,以鹼性蛋白酶套用最多。
 鹽析後膠原蛋白電泳圖譜
鹽析後膠原蛋白電泳圖譜將膠原進行限制性降解,即將末端肽切割下來,由於膠原肽鏈間的共價鍵都是通過分子末端肽里的賴氨酸或羥賴氨酸的相互作用形成的,末端肽被切下後,含三螺旋結構的主體部分可溶於稀有機酸而被提取出來。用酶處理,可以水解掉膠原纖維蛋白的末端肽,提高膠原蛋白的產率;而且還不會破壞膠原蛋白的三股螺旋結構,保持其特性。影響酶提取的因素有很多,如酶濃度、酶與底物的比例、酶解時間、酶解溫度、pH值以及料液比等。在實際操作中,大多數採用酶複合法提取膠原蛋白,較多的是使用胃蛋白酶提取,有機酸多為乙酸。
酶解膠原蛋白的工藝主要分為單酶水解法和多酶水解法。多酶水解法又分為混合酶水解法(比如牛胰蛋白酶,鏈黴菌蛋白酶,芽孢桿菌蛋白酶混合)和分步酶水解法,酶法提取皮膠原具體實驗工藝及條件的選取通常應考慮要開發的產品對分子量的要求,要得到分子量較小的膠原多肽一般採用多酶水解法。影響酶解效果的因素主要有:酶的種類、加酶量、酶解溫度、酶解時間、pH值及料水比。採用酶法提取骨料中的膠原蛋白,既能有效縮短提取時間,又能獲得具有良好生物活性的膠原蛋白,而且對環境的污染也較小。膠原蛋白不易被普通蛋白酶水解,但能被動物膠原酶斷裂,斷裂的碎片自動變性後可被普通蛋白酶水解。胃蛋白酶水解膠原蛋白的適宜條件為pH 1.65~1.70、溫度37℃。
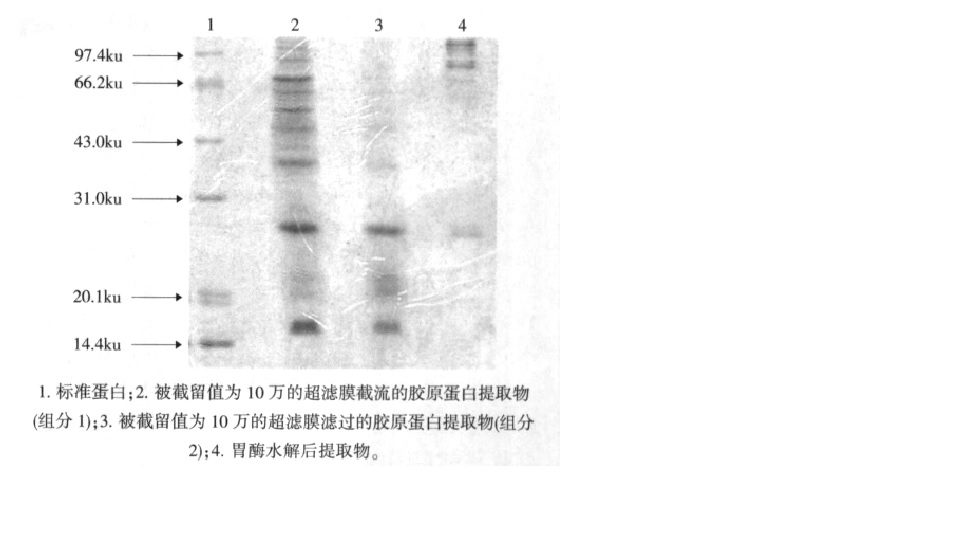 胃蛋白酶提取膠原蛋白的電泳圖譜
胃蛋白酶提取膠原蛋白的電泳圖譜有人以豬骨為原料,用蛋白酶的酶解反應代替傳統制膠工藝,對骨膠原的酶解反應與酶法制膠工藝進行了試驗研究。結果表明:以胃蛋白酶對骨膠原的提取率最高(46.14%),其次是胰蛋白酶(43.42%),接下來是中性蛋白酶(30.14%),最後是鹼性蛋白酶(21.15%)。並且通過單因素和正交試驗對胃蛋白酶酶解反應中各主要影響因素進行了最佳化。試驗結果表明,胃蛋白酶提取的最優條件是,胃蛋白酶的濃度是1%,在pH2.0的條件下酶解48h,然後在濃度為10%(w/v)的NaCL溶液中鹽析24h,最後骨膠原的回收率為64.77%,骨膠原的提取率為49.75%。還有人用胃蛋白酶提取豬皮膠原蛋白,分別在水解0、2、6、10、14、18、22、26h時對四種不同胃蛋白酶用量(分別為1%、2%、2.5%、3%)的試樣取樣檢測,採用一階HILL方程模擬胃蛋白酶提取豬皮膠原蛋白的進程以及胃蛋白酶水解速率的衰減過程,最後得出2%的胃蛋白酶用量和6-7h的水解時間提取率最大。還有人用以新鮮豬皮為原料,在50-52℃的條件下用胰酶進行水解,在酶用量為 5000:1~10000:1,pH值為9,反應2-3h,原料:水為1:2的條件下酶解。結果表明:總蛋白質的提取率≥80%。
採用酶法提取膠原蛋白時,必須嚴格控制提取條件:
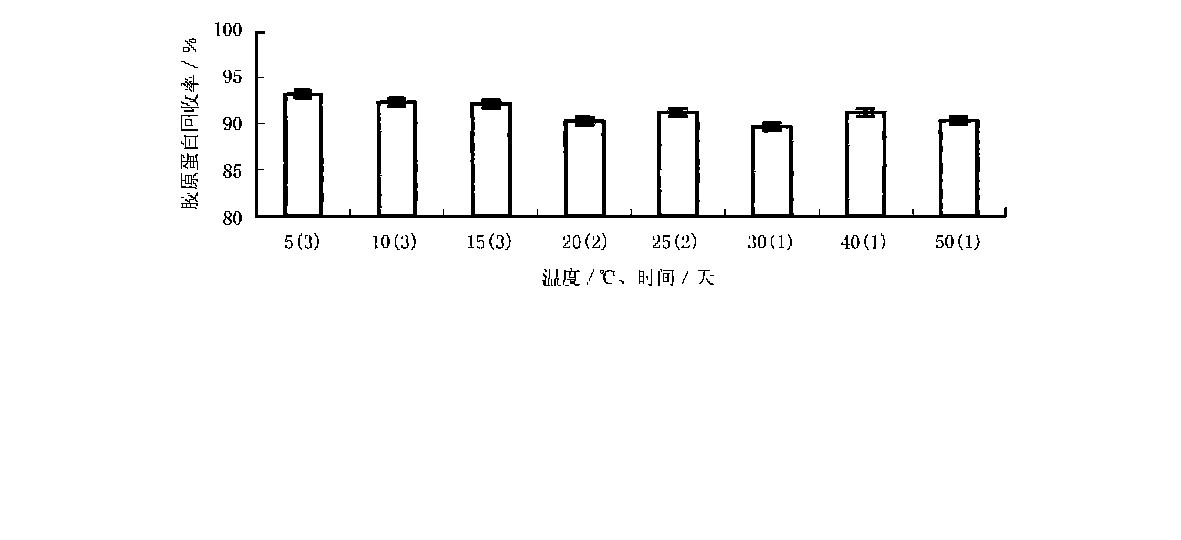 變溫下胃蛋白酶對魷魚皮中膠原蛋白的回收率
變溫下胃蛋白酶對魷魚皮中膠原蛋白的回收率首先,酶作用時間必須適當。如果時間過短,膠原蛋白就不能充分釋放到提取液中,影響提取率;如果酶作用時間過長,膠原蛋白會水解過度,產生過多的苦味小分子低聚肽,不僅會增加分離純化的難度,也會影響膠原蛋白的功能特性和生物活性。
其次,酶解溫度要適宜。溫度過低,酶的作用效果不明顯;溫度過高會引起酶的失活和膠原蛋白的變性。據報導,當介質pH略低於中性時,膠原蛋白的變性溫度為40~41℃,當介質pH為酸性時,膠原蛋白的變性溫度為38~39℃,而且魚皮膠原蛋白的變性溫度要比豬皮膠原蛋白的變性溫度低7~12℃。所以,如果要使提取的膠原蛋白具有良好的生物活性,在提取過程中應使提取溫度低於變性溫度。
第三,需選用適當的酶。一般從陸生哺乳動物組織中提取膠原蛋白時,採用胃蛋白酶在其最適作用溫度下進行提取是合理的,但對於魚類等水生動物,由於其膠原蛋白的變性溫度比陸生哺乳動物低,因此許多蛋白酶便不適用,如果在這些酶的最適作用溫度下提取可能會破壞膠原蛋白的某些功能特性和生物活性。採用酶法提取膠原蛋白及其多肽的研究主要是從動物皮及其加工副產物中,套用酶法從動物骨中提取膠原蛋白及其多肽報導較少。
純化
可用於膠原蛋白的純化方法包括鹽析法、透析法、離心法、電泳法和色譜法,其中鹽析法、離心法和電泳法最為常用。由於單一方法難以完全分離純化膠原蛋白,實際操作都是通過複合法來達到分離純化膠原蛋白的目的。鹽析法一般採用高濃度NaCl;離心法常選用製備型低溫超速離心機;電泳法多採用十二烷基硫酸鈉聚丙烯醯胺凝膠電泳法(SDS-PAGE),該法既可用於膠原蛋白的分離純化,還可用來測定膠原蛋白分子的相對分子質量。像有人用破碎、酶解、鹽析三步法提純蘇尼特羊骨骼I型膠原蛋白。先去除骨頭裡的非膠原物質,然後往沉澱中10%的胃蛋白酶,在4℃的條件下消化24h,以14000r/min離心40min。棄沉澱往上清液中加NaCL,使它終濃度達到0.9moL/L,靜止過夜,再離心,最後的沉澱就是I型膠原蛋白。
改性
交聯
指使膠原分子內部和分子間通過共價健結合提高膠原纖維的張力和穩定性的方法。該法又分為物理方法、化學方法和低溫電漿法,生物學方法;其中物理方法、化學方法是最常用的交聯改性方法,生物學方法改性膠原蛋白主要在研究有關動物老化的生命現象中涉及,在研製膠原基生物醫學材料中少見報導。
物理方法
通過物理手段對膠原蛋白改性有紫外線照射、
重度脫水、λ射線照射和熱交聯等方法。膠原溶液如被紫外線等照射,將在分子間產生交聯,粘度增加,生成凝膠。常用的紫外線交聯膠原膜的方法是將膠原膜放在鋁箔上,距離254 nm紫外燈20 cm高度,照射1~5 h。對紫外線照射的膠原膜進行力學性能和膠原酶試驗表明:交聯膠原膜的萎縮溫度Ts和抗膠原酶解的能力均顯著高於未交聯膠原膜。
重度脫水也是膠原蛋白物理改性中常使用的方法,該法是通過脫水導致膠原分子間交聯,從而增加變性溫度,改善膠原的性能。改性後膠原膜生物相容性提高,降低了水溶性,影響了膜與成骨細胞的生物相容性。物理方法改性原蛋白的優點是可避免外源性有毒化學物質進入膠原內,缺點是膠原膜交聯度低,且難以獲得均勻一致的交聯。
化學方法
化學方法比物理方法改性交聯度高,且能獲得均勻一致的交聯,對調節、控制膠原的各性質均有效。已廣泛套用於各種化學試劑交聯膠原,以提高其交聯度、力學性能及生物相容性。化學改性法具體又可分為使用化學試劑交聯、側鏈的修飾、生理活性物的固定化三種方法。
化學試劑交聯法中常用的化學交聯劑有戊二醛、己異二氰酸酯、碳化二亞胺、疊氮二苯基磷等,其中戊二醛是套用最廣泛的試劑,大量實驗證明:戊二醛能提供有效交聯,但有細胞毒性,且其用量難以控制。另外,隨著交聯度的增加,吸水能力和膨脹度卻會降低。醯基疊氮化物、聚環氧化物或京尼平交聯等,不會引入明顯的毒性,且可獲得理想的交聯效果。所見報導中,多使用單一交聯劑對膠原蛋白交聯改性,但也有使用混合交聯劑的,如為了解決人工心臟瓣膜晚期鈣化問題,篩選出環氧丙烷化學改性戊二醛處理生物瓣的方法,可明顯減低瓣膜組織膠原蛋白末端游離羧基含量。動物實驗表明,經改性後的瓣膜組織能保持較好的組織穩定性和機械抗張強度、免疫原性測試為陰性,符合臨床套用。
側鏈修飾就是對膠原分子側鏈的氨基和羧基進行化學修飾,改善電荷分布,使膠原獲得新的特性,例如將膠原氨基丁二醯化,可變成負電荷豐富的膠原。與未修飾膠原蛋白相比血小板粘附能,血纖維蛋白形成能都弱,有抗栓性;然而如將膠原羧基甲基化獲得的正電荷豐富的膠原,生理條件下血小板粘附能、活化能都高。與交聯改性相比,在生物材料領域,利用側鏈修飾對膠原改性所做的工作還較少。
化學方法雖然可獲得均勻一致的交聯,但存在著引入外源有毒試劑,殘留試劑難清除等缺點。一些報導表明,低溫電漿技術改性膠原或膠原複合膜可使材料表面引入不同基團,改變材料表面化學組分和結構,從而改變材料的特性,如使之更具有細胞識別位,提高表面能,改善表面極性等。
與其它高分子共混
膠原單獨使用,物理機械性能差(這幾乎是天然材料共有的弱點),性能單一,且因有親水性強,在體內易被膠原酶降解等不可避免的弱點限制了它的套用。但如將膠原與其它物理、化學性質不同的合成或天然高分子共混,組成一種多相固體材料,在性能上膠原與其它高分子互相補充,膠原基“複合材料”的概念由此產生。
已見報導的與膠原共混的合成高分子有不可生物降解的聚甲基烯酸酯及丁烯酸酯、聚氨酯、聚醯胺和可生物降解的聚乙烯醇、聚乳酸、聚谷氨酸、聚乙醇酸等,20世紀80~90年代初最有代表性的是聚甲基丙烯酸羥乙酯(PHEMA)和聚乙烯醇與膠原共混,其報導集中於複合方法、複合機理、理化及生物學性能、材料表面和整體結構、表面修飾的方法和機理以及水凝膠的溶脹擴散等,尤其是水凝膠製備、作軟組織替代、藥物緩釋等。後來利用可生物降解的聚乳酸、聚乙醇酸、聚酸酐、聚谷氨酸、聚亞乙基四乙酸等與膠原共混改性製備可吸收外科縫線、組織工程支架材料(如組織引導再生材料)的相關研究相對增多。不過合成高分子與膠原蛋白共混複合一些問題,如尼龍等不降解高分子材料不能進行生理代謝,與膠原蛋白複合後只能用做皮膚的外層敷料不能永久代替皮膚,而聚谷氨酸等可生物降解材料,如果相對分子質量小則強度不夠,相對分子質量大難溶於水,溶解時還出現降解,影響材料的機械強度。
天然高分子材料中最具代表性的是天然蛋白質和天然多糖,多糖主要有軟骨素、HA(透明質酸)、殼聚糖、肝素等,多糖複合材料比較集中於可吸收性外科縫線、藥物釋放的載體、皮膚替代物、透析膜、止血劑、醫用引導組織再生材料、骨替代材料、組織培養系統的支架。
生物學性狀
低免疫原性
膠原作為醫用生物材料,最重要的特點在於其低
免疫原性,與其它具有免疫原性的蛋白質相比,膠原蛋白的免疫原性非常低。人們甚至曾認為膠原不具有
抗原性,研究表明:膠原具有低免疫原性,不含端肽時免疫原性尤其低。
 膠原蛋白臨床套用出現的免疫學反應
膠原蛋白臨床套用出現的免疫學反應膠原有三種類型的抗原分子:
第一類是膠原肽鏈非螺旋的端肽,在天然和變性膠原中均存在。由於2個不同種類的哺乳動物中間的膠原蛋白,其整個
胺基酸序列變化不是很大,而且膠原蛋白的三螺旋區域有高度的進化穩定性,但在非螺旋的末端區域中有很大的變化性,在這區域中幾乎50%以上的胺基酸殘基表現出種屬性變化,大量的研究和生產都集中在如何完全去除端肽,只要去除端肽就認為是安全的。
第二類是膠原的三股螺旋的構象,僅存在於天然膠原分子中,即位於天然膠原蛋白的三螺旋結構中的抗原決定簇,會在分離和純化過程中暴露出來,尤其是含α1和α2單鏈暴露出的中央端情況下更為明顯。
第三類是α-鏈螺旋區的胺基酸順序,只出現在變性膠原中。
免疫學分析和研究結果表明,使用膠原加完全
弗氏佐劑,能對膠原產生多克隆和單克隆抗體。由T細胞啟動的對膠原蛋白
免疫反應的證據是,位於重要組織相容性(H-2)部位上ⅠA或ⅠB亞區的免疫反應基因已被鑑定。
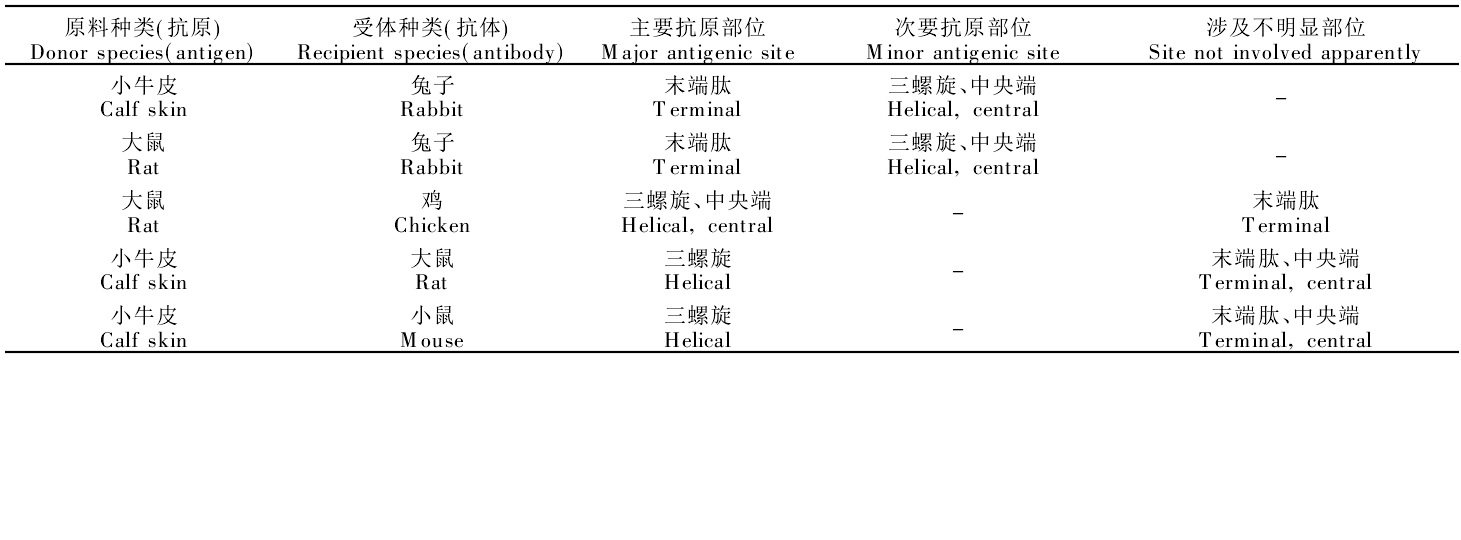 膠原蛋白抗原-抗體反應的概況
膠原蛋白抗原-抗體反應的概況膠原蛋白免疫原性的臨床評價通常是皮膚過敏性測試(細胞免疫指數,遲發性Ⅳ型反應)和由反應型抗體的存在(體液免疫指數)來確定的。實踐證明,在患者身上進行這兩種評價是合理的。
在治療前,用過敏劑量的植入性膠原對患者進行皮試,大約3%有潛在的反應,反覆多次處理的患者,大約1%~2%會產生遲發性過敏性的臨床病狀。典型的症狀包括局部水腫和紅斑反應,有的還伴有硬化和瘙癢,持續時間4~6個月,個別甚至可達1年以上。
相容性
生物相容性是指膠原與宿主細胞及組織之間良好的相互作用。膠原本身是構成細胞外基質的骨架,其三股螺旋結構及交聯所形成的纖維或網路對細胞起到錨定和支持作用,並為細胞的增值生長提供適當的微環境。無論是在被吸收前作為新組織的骨架,還是被吸收同化進入宿主成為宿主的一部分,都與細胞周圍的基質有著良好的相互作用,表現出相互影響的協調性,並成為細胞與組織正常生理功能整體的一部分。比如海綿狀I型膠原蛋白與兔脂肪幹細胞具有良好的體外生物相容性,能為組織工程種子細胞的生長提供適宜的三維空間,可作為脂肪組織工程種子細胞的載體材料。
可降解性
膠原能被特定的蛋白酶降解,即生物降解性。因膠原具有緊密牢固的螺旋結構,所以絕大多數蛋白酶只能切斷其側鏈,只有膠原酶、彈性蛋白酶等特定的蛋白酶在特定的條件下才能降解膠原蛋白,斷裂膠原肽鍵。膠原的肽鍵一旦斷裂,其螺旋結構隨即被破壞而徹底水解為小分子多肽或胺基酸,小分子物質可以進入血液循環系統,被機體重新利用或代謝排出。可生物降解性是膠原蛋白能作器官移植材料被利用的基礎。
凝血性
膠原具有止血性能,該性能的發揮通過兩方面實現,即促進血小板凝聚和血漿結塊。膠原可以與血小板通過粘合、聚集形成血栓起到止血作用。當血管壁的內皮細胞被剝離時,血管中的膠原纖維暴露於血液中,血液中的血小板立刻與膠原纖維吸附在一起,發生凝聚反應,生成纖維蛋白並形成血栓,進而血漿結塊阻止血流。膠原的天然結構膠原具有凝聚能力的基礎。膠原是參與創傷癒合的主要結構蛋白。止血活性依賴於膠原聚集體的大小和分子的天然結構,變性的膠原(明膠)誘導止血無效。研究表明,膠原蛋白能有效誘導血小板聚集,與二磷酸腺苷比較,膠原蛋白誘導不受初始劑量、濃度等因素的影響,表現迅速而徹底。
套用
生物醫學材料
膠原蛋白是肌體自然蛋白,對皮膚表面的蛋白質分子具有較大的親和力、較弱的抗原性、良好的生物相容性和生物降解安全性,可降解吸收,粘著力好。由膠原製成的手術縫合線既有與天然絲一樣的高強度,又有可吸收性,在使用時既有優良的血小板凝聚性能,止血效果好,又有較好的平滑性和彈性,縫合結頭不易鬆散,操作過程中不易損傷機體組織,對創面有很好的黏附性,一般情況下只需較短時間的壓迫就可達到滿意的止血效果。所以膠原蛋白可以製成粉狀、扁狀及海綿狀的止血劑。同時用合成材料或膠原蛋白在血漿代用品、人造皮膚、人工血管、骨的修復和人工骨和固定化酶的載體等方面的研究和套用方面都十分的廣泛。
膠原蛋白分子肽鏈上具有多種反應基團,如羥基、羧基和氨基等,易於吸收和結合多種酶和細胞,實現固定化,它具有與酶和細胞親合性好、適應性強的特點。另外,膠原易加工成型,故純化的膠原蛋白可製成許多不同形式的材料,如膜,帶,薄片,海綿,珠體等,但以膜形式套用的報導最多。膠原製備膜用於生物醫學,除具有生物可降解性、組織可吸收性、生物相容性、弱抗原性外,還主要有:親水性強,抗張強度高,具有類似真皮的形態結構,透水透氣性好;高抗張強度和低延展性決定的生物塑性;官能團多,可進行適度交聯改性,從而可控制其生物降解速度;可調節溶解(溶脹)性;與其它生物活性組分一起使用,具有協同效應;可與藥物相互作用;交聯或酶處理去端肽可使抗原性降低,可隔離微生物,有生理活性,如有血凝作用等優點。同時也存在以下缺點:膠原的分離純化及加工處理複雜,分離的膠原交聯密度、纖維大小等具有多樣性。酶解膠原速度多變,條件難於控制;且純膠原乾燥後質地脆,成膜能力並不強,其膜延展性低,易乾裂,抗水性差,遇水易溶脹,在體內易降解,潮濕環境中易受細菌侵蝕而變質,此外還可能導致一些副反應,如組織鈣化等。故實際套用中,常常通過一定方法將膠原蛋白改性,通過改性避免膠原蛋白製備材料的缺點,提高膠原的拉伸強度及抗降解能力,降低膨脹率,改善膠原的力學性能與抗水性。
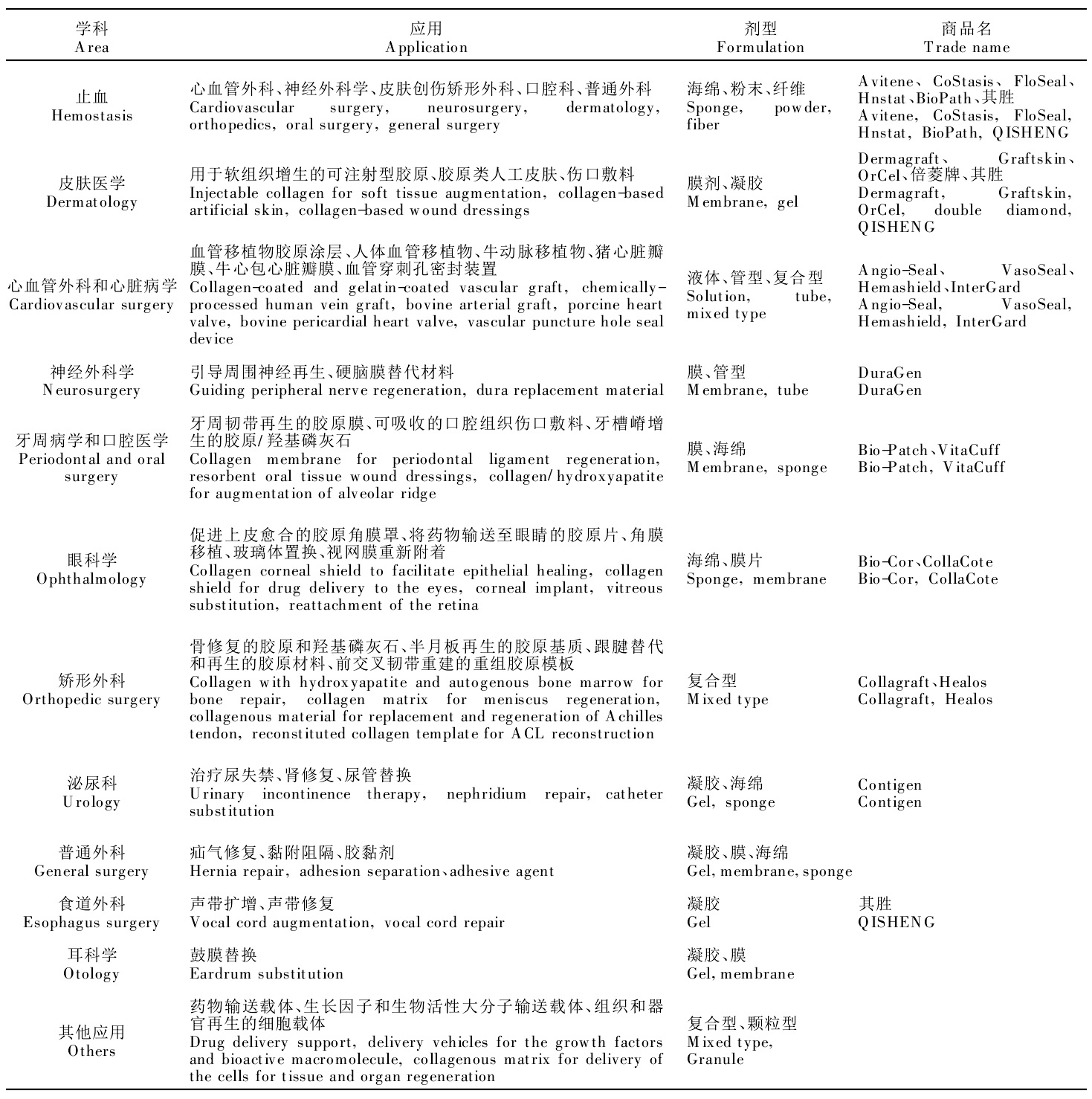 膠原類醫用產品的臨床套用
膠原類醫用產品的臨床套用臨床套用形式有水溶液、凝膠、顆粒劑、海綿和薄膜等。同樣這些形狀都可用於藥物緩釋,已獲準上市和正在研發的膠原蛋白藥物緩釋套用大都集中在眼科中抗感染和青光眼治療,創傷中的局部治療及傷口修復的控制感染,婦科的宮頸發育異常和外科的局部麻醉等。
 膠原蛋白藥物緩釋套用
膠原蛋白藥物緩釋套用組織工程
由於膠原蛋白廣布於人體各組織中,系各組織中的重要成分並構成組織細胞外基質(Extracelluarmatrix,ECM),其性質是一種天然的組織支架材料。從臨床套用的角度,人們用膠原蛋白製成各種各樣的組織工程支架,如皮膚、骨組織、氣管和血管支架等。然而以膠原本身而言就有兩大類,即純膠原製備的支架和與其它成分複合而成的複合物支架。純膠原蛋白組織工程支架具有生物相容性好、易加工、可塑性並能促進細胞黏附、增殖等優點,但也有膠原蛋白的力學性能差,在含水時難以塑形,無法支撐組織重建等不足。其次在修復處的新生組織會產生各種各樣的酶,將膠原蛋白水解,導致支架崩解,而採用交聯或複合的方式能改善與提高。現已成功地將膠原蛋白基生物材料用於人工皮膚、人工骨、軟骨移植和神經導管等組織工程產品。有人用嵌入軟骨細胞的膠原蛋白凝膠來修復軟骨缺陷並嘗試用上皮、內皮和角膜細胞附在膠原蛋白海綿以適應角膜組織。還有人混合自體同源的間葉細胞中的莖狀細胞和膠原蛋白凝膠製作肌腱用於腱後修復。
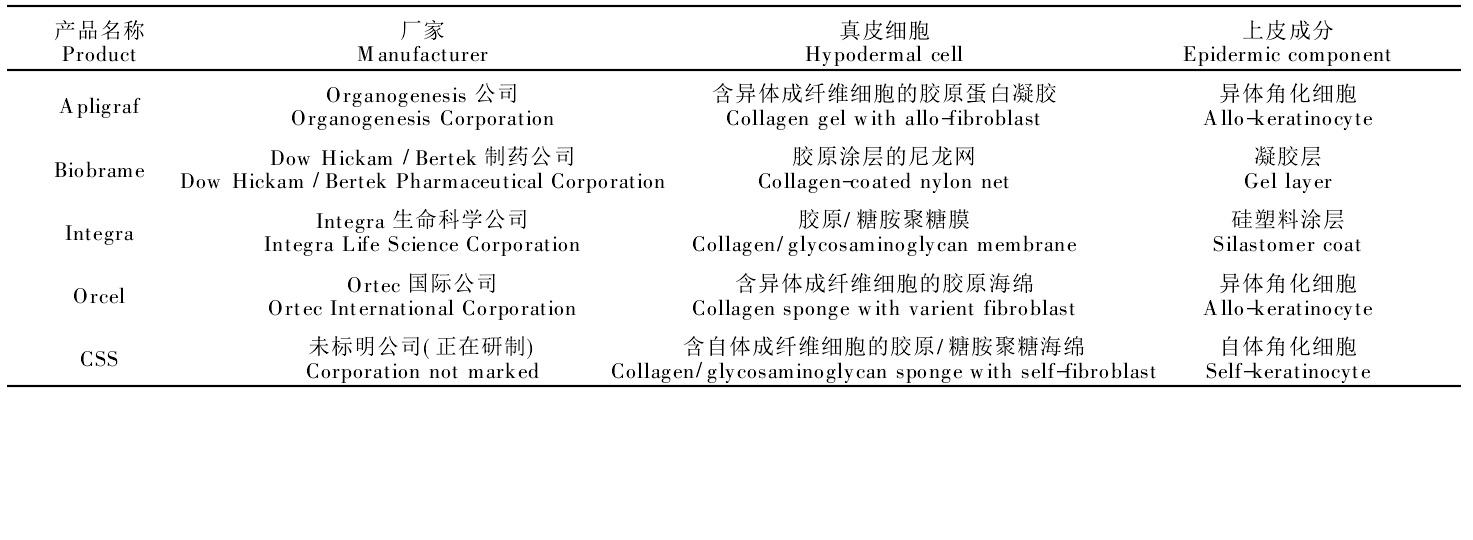 膠原基組織工程皮膚
膠原基組織工程皮膚以膠原蛋白為基質作真皮輔以上皮成分構成的組織工程人工皮膚藥物緩釋膠以膠原蛋白為主要成分的給藥系統套用非常廣泛,可以把膠原蛋白水溶液塑造成各種形式的給藥系統,如眼科方面的膠原蛋白保護物、燒傷或創傷使用的膠原海綿、蛋白質傳輸的微粒、膠原蛋白的凝膠形式、透過皮膚給藥的調控材料以及基因傳輸的納米微粒等。此外,還可作為組織工程包括細胞培養系統的基質、人工血管和瓣膜的支架材料等。
燒傷
自體皮膚移植一直是治療二度和三度燒傷的全球標準方法,然而對於嚴重燒傷的病人,缺少合適的可移植的皮膚成了最嚴峻的問題,有人利用生物工程技術通過嬰兒皮膚細胞培育出嬰兒皮膚組織,這種膠原蛋白組織在沒有自體移植的情況下,在3周到18個月不等的時間裡可治癒不同程度的燒傷,而且新長出的皮膚也很少表現出肥大增生和抗性。還有人用人工合成的聚-DL-乳酸-羥基乙酸(PLGA)和天然膠原蛋白來培育三維的人皮膚纖維原細胞,結果表明:細胞在合成網狀物上生長更快,而且內外幾乎同步生長,增殖細胞和分泌的胞外基質更均一,把這種纖維植入無皮的大鼠背部,2周后就長出了真皮組織,4周后就長出了上皮組織。
美容
膠原蛋白由動物皮提取,皮中除膠原蛋白外還含有透明質酸、硫酸軟骨素等蛋白多糖,它們含有大量極性基團,是保濕因子,且有阻止皮膚中的酪氨酸轉化為黑色素的作用,故膠原蛋白有純天然保濕、美白、防皺、祛斑等作用,可廣泛套用於美容用品中。膠原蛋白的化學組成、結構賦予了它是美容的基礎。膠原蛋白與人體皮膚膠原的結構相似,為非水溶性纖維狀含糖蛋白質,分子中富含大量胺基酸和親水基,具有一定的表面活性和很好的相容性,同時由於其分子中含有大量的羥基,因此它有著相當好的保濕作用。在相對濕度70%時,仍可保持其自身重量45%的水分。試驗證明:0.01%的膠原蛋白純溶液就能形成很好的保水層,供給皮膚所需要的全部水分。
隨著年齡的增長,成纖維細胞的合成能力下降,若皮膚中缺乏膠原蛋白,膠原纖維就會發生聯固化,使細胞間粘多糖減少,皮膚便會失去柔軟、彈性和光澤,發生老化,同時真皮的纖維斷裂、脂肪萎縮、汗腺及皮脂腺分泌減少,使皮膚出現色斑、皺紋等一系列老化現象。將其作為活性物質用於化妝品中時,後者可以擴散到皮膚的深層,其含有的酪氨酸與皮膚中的酪氨酸競爭,而與酪氨酸酶的催化中心結合,從而抑制黑色素的產生,使皮膚中的膠原蛋白活性增強,保持角質層水分以及纖維結構的完整性,促進皮膚組織的新陳代謝,對皮膚產生良好的滋潤保濕、消皺美容作用。早在20世紀70年代初,美國就率先推出注射用牛膠原,用於祛斑除皺紋及修復瘢痕。
不過在化妝品中,單純用作營養性護膚類原料通常要求分子量在2KD以下,以讓水解膠原能滲透入皮膚內。而護髮類化妝品除要求水解膠原具有保濕性以外,還應具有一定的成膜性,因此,水解膠原的分子量要求會更高。
食品
膠原蛋白亦可用於食品,早在十二世紀Bingen 的 St.Hilde-gard 就描述了利用小牛的軟骨湯作為藥物來治療關節疼痛,在相當長的一段時間裡,含膠原的一些產品被人們認為對關節是很有益處的。因為它具有適用於食品的一些屬性:食用級通常外觀為白色,口感柔和,味道清淡,易消化。可以降低血甘油三酯和膽固醇,並可以增高體內某些缺乏的必需微量元素使之維持在一個相對的正常範圍之內,它是一種理想的降血脂食品。此外,有研究表明,膠原蛋白可以協助排除體內的鋁,減少鋁在體內的聚集,降低鋁質對人體的危害,並一定程度上促進指甲和頭髮的生長。Ⅱ型膠原是關節軟骨中的主要蛋白,因而是潛在的自身抗原。口服後能誘導T細胞產生免疫耐受,從而抑制T細胞介導的自身免疫性疾病。膠原多肽是膠原或明膠經蛋白酶等降解處理後製得的具有較高消化吸收性、分子量約為2000~30000的產物,不具有明膠的凝膠性能,市場上銷售的膠原多為膠原多肽。
膠原的一些品質使得它在許多食品中用作功能物質和營養成分具有其它替代材料難以比擬的優點:膠原大分子的螺旋結構和存在結晶區使其具有一定的熱穩定性;膠原天然的緊密的纖維結構使膠原材料顯示出很強的韌性和強度,適用於薄膜材料的製備;由於膠原分子鏈上含有大量的親水基團,所以與水結合的能力很強,這一性質使膠原在食品中可以用作填充劑和凝膠;膠原在酸性和鹼性介質中膨脹,這一性質也套用於製備膠原基材料的處理工藝中。
膠原蛋白粉可直接加入到肉製品,以影響肉類的嫩度和肉類蒸煮後肌肉的紋理。研究表明,膠原蛋白對原料肉和烹飪肉質地的形成非常重要,膠原蛋白含量越高,肉的質地越硬。像魚肉的嫩化被認為與V型膠原蛋白降解有關,其肽鍵的破壞引起的細胞外周膠原纖維的裂解被認為是肌肉嫩化現象的主要原因。通過破壞膠原蛋白分子內的氫鍵,使原有的緊密超螺旋結構破壞,形成分子較小、結構較為鬆散的明膠,既可改善肉質的嫩度又可提高其使用價值,使其具有良好的品質,增加蛋白質含量,既口感好又有營養。日本還開發出了動物膠原蛋白為原料經膠原蛋白水解酶水解、調製開發出新型調味品和清酒,不但有特殊的風味,還能補充部分胺基酸。
隨著各類香腸製品在肉製品中所占的比例越來越大,天然的腸衣製品嚴重缺乏。研究人員正致力於替代品的開發,以膠原蛋白質為主要的膠原腸衣本身是營養豐富的高蛋白物質,在熱處理過程中隨著水分和油脂的蒸發與溶化,膠原幾乎與肉食品的收縮率一致,而其他的可食用包裝材料還沒有被發現具有這種品質。另外,膠原蛋白本身具有固定化酶的功能,具有抗氧化性,可以改善食品的風味和質量。產品應力與膠原蛋白含量的多少成正比,而應變則成反比。
骨骼
膠原蛋白是人體骨骼,尤其是軟骨組織中的重要組成成分。膠原蛋白就像骨骼中的一張充滿小洞的網,它會牢牢地留住就要流失的鈣質。沒有這張充滿小洞的網,即便是補充了過量的鈣,也會白白地流失掉。而膠原蛋白的特徵胺基酸羥基脯氨酸是血漿中運輸鈣到骨細胞的工具。骨細胞中的骨膠原是羥基磷灰石的黏合劑,它與羥基磷灰石共同構成了骨骼的主體。而骨質疏鬆的實質是合成骨膠原的速度跟不上需要,換言之,新的骨膠原的生成速度低於老的骨膠原發生變異或老化速度。研究表明,如果缺少膠原蛋白,補充再多的鈣質也無法防止骨質疏鬆,因此,只有攝入足夠的可與鈣結合的膠原蛋白,才能使鈣在體內被較快消化吸收,且能較快的達到骨骼部位而沉積。
將膠原蛋白和聚乙烯吡咯烷酮溶在檸檬酸緩衝液里製得膠原蛋白-PVP聚合物(C-PVP),用於受傷骨骼的加固不僅效果好,安全性也高,即使長周期的連續用藥,不管是實驗還是臨床試驗都不表現出淋巴腫大、DNA損傷,不會引起肝和腎的代謝紊亂,也不誘發人體產生抗C- PVP的抗體。
飼料
飼料用膠原蛋白粉是以製革的殘次皮料、皮邊角余料等副產物為原料,運用物理、化學或生物技術方法處理得到的蛋白質產品。製革廠鞣革後勻削和剪裁產生的固體廢棄物統稱為鞣革廢渣,其乾物質的主要成分就是膠原蛋白。處理後可作為一種動物源性蛋白營養添加劑,替代或部分替代進口魚粉,用於混、配合飼料的生產,具有較好的飼餵效果和經濟效益。其蛋白質含量高,富含18種以上胺基酸,含有鈣、磷、鐵、錳、硒等礦物質元素,並帶有芳香味。研究表明,水解膠原蛋白粉可部分或全部替代生長肥育豬日糧中的魚粉或豆粕,但添加比例不能超過 6%,當含量達 8%時則顯著降低生產性能及日糧消化率,增加飼養成本。
還有人進行了生長試驗和消化試驗以評價水產飼料中膠原蛋白替代魚粉的效果。生長試驗是在基礎飼料(對照組,含魚粉 12%)中分別以 2%、4%膠原蛋白等重量替代魚粉飼養平均體重6.5g的異育銀鯽(共 315 尾)35 d,各組魚體增重率分別為 71.3%、70.9%、71.9%,各組間沒有顯著差異(P>0.05);消化試驗是採用平均體重 110g 的異育銀鯽,按套算法測定了異育銀鯽對膠原蛋白的蛋白質消化率為 97.3%。研究結果表明,膠原蛋白具有很高的消化吸收率,可部分替代魚粉而對異育銀鯽的增重無影響。
其他
有人研究了膳食銅缺乏與老鼠心臟膠原蛋白含量之間的關係。通過SDS- PAGE分析,再用考馬斯亮藍染色,結果表明檢測改變了的膠原蛋白的額外代謝特徵可預測銅缺乏;由於肝臟纖維化可減少蛋白質含量,因此還可通過測定肝臟中膠原蛋白的含量來預測肝臟纖維化。Anoectochilusformosanus的水提取物(AFE)則可降低CCl4誘發的肝臟纖維化,降低肝臟膠原蛋白的含量。膠原蛋白還是鞏膜的主要成分,對眼睛的作用也非常重要,如果鞏膜中膠原蛋白的合成減少而降解增加就會導致近視。
 Ⅰ型膠原蛋白的電泳圖譜
Ⅰ型膠原蛋白的電泳圖譜 膠原、明膠和水解膠原蛋白的電泳分析
膠原、明膠和水解膠原蛋白的電泳分析 膠原蛋白DSC圖譜
膠原蛋白DSC圖譜 豬皮膠原蛋白電泳圖譜
豬皮膠原蛋白電泳圖譜 膠原蛋白紫外光譜分析
膠原蛋白紫外光譜分析 中性環境中魚鱗膠原蛋白的AFM圖像
中性環境中魚鱗膠原蛋白的AFM圖像 膠原多肽胺基酸組成譜圖
膠原多肽胺基酸組成譜圖 酸性環境中魚鱗膠原蛋白的AFM圖像
酸性環境中魚鱗膠原蛋白的AFM圖像 灰星鯊魚皮、骨膠原蛋白的電泳圖譜
灰星鯊魚皮、骨膠原蛋白的電泳圖譜 膠原蛋白羥脯氨酸含量和熱收縮溫度
膠原蛋白羥脯氨酸含量和熱收縮溫度 水提取膠原蛋白
水提取膠原蛋白 酸提取膠原蛋白
酸提取膠原蛋白 鹼提取膠原蛋白工藝流程
鹼提取膠原蛋白工藝流程 膠原蛋白鹽析工藝流程
膠原蛋白鹽析工藝流程 鹽析後膠原蛋白電泳圖譜
鹽析後膠原蛋白電泳圖譜 胃蛋白酶提取膠原蛋白的電泳圖譜
胃蛋白酶提取膠原蛋白的電泳圖譜 變溫下胃蛋白酶對魷魚皮中膠原蛋白的回收率
變溫下胃蛋白酶對魷魚皮中膠原蛋白的回收率 膠原蛋白臨床套用出現的免疫學反應
膠原蛋白臨床套用出現的免疫學反應 膠原蛋白抗原-抗體反應的概況
膠原蛋白抗原-抗體反應的概況 膠原類醫用產品的臨床套用
膠原類醫用產品的臨床套用 膠原蛋白藥物緩釋套用
膠原蛋白藥物緩釋套用 膠原基組織工程皮膚
膠原基組織工程皮膚