脂質體(Liposomes)是由卵磷脂和神經醯胺等製得的脂質體(空心),具有的雙分子層結構與皮膚細胞膜結構相同,對皮膚有優良的保濕作用,尤其是包敷了保濕物質如透明質酸、聚葡糖苷等的脂質體是更優秀的保濕性物質。
基本介紹
- 中文名:脂質體
- 外文名:liposome
- 類別:人工膜
- 直徑:25~1000nm不等
簡介
 脂質體
脂質體分類
組成結構
質量控制
 脂質體
脂質體特點
製備方法
 脂質體
脂質體 脂質體
脂質體 脂質體
脂質體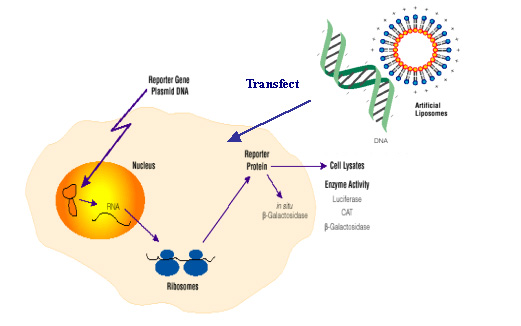 脂質體
脂質體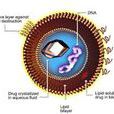
脂質體(Liposomes)是由卵磷脂和神經醯胺等製得的脂質體(空心),具有的雙分子層結構與皮膚細胞膜結構相同,對皮膚有優良的保濕作用,尤其是包敷了保濕物質如透明質酸、聚葡糖苷等的脂質體是更優秀的保濕性物質。
 脂質體
脂質體 脂質體
脂質體 脂質體
脂質體 脂質體
脂質體 脂質體
脂質體 脂質體
脂質體脂質體(Liposomes)是由卵磷脂和神經醯胺等製得的脂質體(空心),具有的雙分子層結構與皮膚細胞膜結構相同,對皮膚有優良的保濕作用,尤其是包敷了保濕物質如透明質酸...
脂質體靶向製劑定義與分類 編輯 靶向製劑亦稱靶向給藥系統(targeting drug delivery system,TDDS)。系指載體將藥物通過局部給藥或全身血液循環而選擇性地濃集定位於...
脂質體(liposomes)是1965年,英國學者bangham將磷脂分散在水中進行電鏡觀察時發現的。...
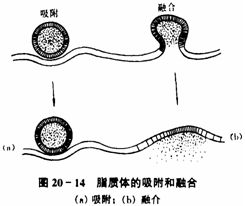
陽離子脂質體表面帶正電荷,能與核酸的磷酸根通過靜電作用,將分子包裹入內,形成脂-複合體,也能被表面帶負電荷的細胞膜吸附,再通過融合或細胞內吞作用偶爾也通過...
《脂質體技術》是2007年人民衛生出版社出版的圖書,作者是鄧英傑。本書是國內第一部全面、系統介紹脂質體技術的學術專著。...
脂質體擠出器(liposomeextruder)又名脂質體擠出儀,薄膜擠出器,主要套用於藥劑產品粒徑均一化,去除產品中的顆粒和沉澱,減小脂質體及乳劑粒徑以便於無菌過濾,分子生物...
本書原著為第二版,是一部經典的實用技術手冊。原著由脂質體各個研究領域的權威專家編寫,內容覆蓋脂質體技術的所有關鍵技術。全書分為兩大部分:第一部分提供了幾乎...
脂質體是磷脂依靠疏水締合作用在水中自發形成的一種分子有序組合體,為多層囊泡結構,每層均為類脂雙分子膜,\n\n長循環脂質體層間和脂質體核心為水相,雙分子膜...
近年來出現的脂質體阿黴素(Liposome doxorubicin)既能加強藥物的抗癌作用,又能減少其毒副作用,逐漸成為卵巢癌治療的二線藥物之一。脂質體阿黴素概述 編輯 ...
脂質體注入法 是往培養細胞等注人生理活性物質的一種操作方法。把磷脂混懸於適當條件的(鹽濃度、溫度)溶液中,形成由脂質的雙層膜包裹的顆粒(脂質體);同日抽口人...
脂質體是磷脂分散在水中時形成的脂質雙分子層,又稱為人工生物膜。...... 脂質體是磷脂分散在水中時形成的脂質雙分子層,又稱為人工生物膜。中文名 脂質體轉染 ...
本書適用於從事藥學、醫學、免疫學、遺傳學、生物物理、生物化學、動植物學、生物工程學、化妝品、農藥等相關學科的科學工作者、研究生等科研人員以及從事脂質體技術...
脂質體轉染法是指陽離子脂質體表面帶正電荷,能與核酸的磷酸根通過靜電作用將DNA分子包裹入內,形成DNA一脂複合體,被表面帶負電荷的細胞膜吸附,再通過膜的融合作用...
在研究的各種新型脂質體中,熱敏脂質體(溫度敏感脂質體)是一個很有發展前途的分支,它有效利用了脂質體和熱療的雙重優勢來提高治療效果,降低毒副作用。 在正常的...
脂質體(liposome,又稱人工膜泡) 作為體內或體外輸送載體的方法,一般都需要將DNA 或RNA 包囊於脂質體內,然後進行脂質體與細胞膜的融合,通過融合導人細胞。...
多室脂質體,又稱多層脂質體是一種藥物溶液被幾層脂質雙分子層所隔開形成的不均勻聚集體。...
最常用的脂質體為陽離子脂質體,主要由帶正電荷的脂類和中性輔助脂類等摩爾混合。陽性電荷的脂質體與帶陰性電荷的DNA之間可以有效地形成複合物,通過內吞作用使複合物...
注射用紫杉醇脂質體,適應症為本品可用於卵巢癌的一線化療及以後卵巢轉移性癌的治療、作為一線化療,本品也可以與順鉑聯合套用。本品也可用於曾用過含阿黴素標準...
注射液鹽酸多柔比星脂質體注射液,通用名為楷萊注射液,英文名Caelyx,本品是一種脂質體製劑。...
屆全國臨床腫瘤學大會暨二00九CSCO學術年會上,上海復旦張江生物醫藥股份有限公司宣布,歷時六年研發,中國自主創新的首枚阿黴素“飛彈”——PEG化脂質體阿黴素(里葆多...
鹽酸多柔比星脂質體注射液,適應症為本品可用於低CD4(<200CD4淋巴細胞/mm)及有廣泛皮膚黏膜內臟疾病的與愛滋病相關的卡波氏肉瘤(AIDS-KS)病人。本品可用作一線...
靶敏感脂質體(target-sensitive liposomes, TS-liposomes)是脂質體在與靶部位結合後能自動去穩定,將內容物釋放出來。對於內吞能力比較弱或沒有內吞能力的靶細胞來...
pH-脂質體是一種具有細胞內靶向和控制藥物()如基因、核酸、肽、蛋白質)釋放的功能性脂質體。...
中文名稱 脂質體包載 英文名稱 liposome entrapment 定義 以脂質體的形式包裹藥物、酶或其他製劑運送入靶細胞的方法。 套用學科 生物化學與分子生物學(一級學科)...
里葆多(鹽酸多柔比星脂質體注射液),適應症為本品可用於低CD4(<200CD4淋巴細胞/mm)及有廣泛皮膚黏膜內臟疾病的與愛滋病相關的卡波氏肉瘤(AIDS-KS)病人。本品...
