白細胞介素-12(IL-12)是具有廣泛生物學活性的細胞因子,主要由激活的炎性細胞產生。
基本介紹
- 中文名:白介素12
- 外文名:Interleukin 12
- 實質:廣泛生物學活性的細胞因子
- 種類:IL-12是一由p35和p40
定義,生成調節,生物學功能,醫學套用,資料與方法,
定義
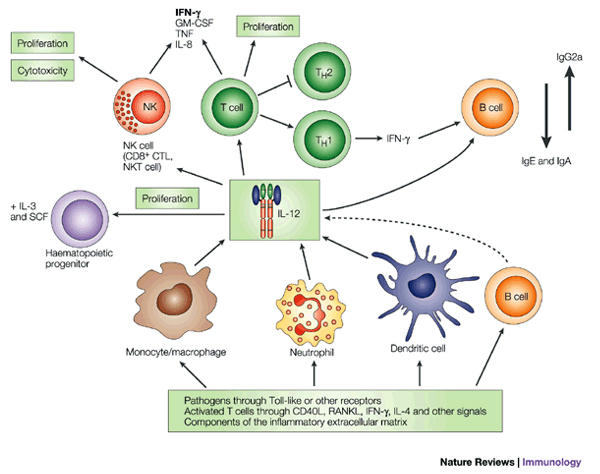
IL-12是一由p35和p40(IL-12β)兩條鏈組成的異源二聚體,兩個亞單位通過二硫鍵連線在一起,這種結構在目前已發現的IL中所罕見。通常情況下,p40的量遠超出p70,在鼠中已觀察到p40同源二聚體的產生,是由轉染的細胞分泌的,p40同源二聚體沒有生物學活性,但它能和IL-12Rβ結合,與p70競爭性爭奪IL-12受體(IL-12R)而拮抗其生物學作用。單獨的p35不具有生物學活性,但卻是合成p70的限速因子。
IL-12受體由IL-12Rβ1和IL-12Rβ2組成,兩鏈激活JAK-STAT(連線蛋白-信號轉導子和轉錄激活子)信號轉導通路,IL-12獨特的細胞效應主要是由於STAT4的活化,由以下事例證明:遺傳上STAT4基因缺陷鼠和IL-p40缺陷鼠有同樣的表型。IL-12R主要由活化的T細胞、NK細胞、DC細胞和B細胞表達。
生成調節
具有生物活性的IL-12主要是激活的炎性細胞(單核巨噬細胞、樹突狀細胞和其他抗原呈遞細胞)產生的,IL-12在和T細胞作用過程中產生IL-12及誘導Th1應答的能力首先在體外實驗中發現,此後在體內發現。DC細胞是合成IL-12的第一個細胞,並發現它依賴於IFN-γ和來自T細胞的信號。和其他的炎症細胞因子相似,IL-12的生成受正性和負性調節機制嚴格控制。來自包括細菌、胞內寄生蟲、真菌、雙鏈DNA及CpG-寡聚核苷酸在內的微生物的產物都是IL-12生成的強有力的誘導劑,不同的細胞因子如IFN-γ、TNF-β、GM-CSF能增強細胞產生IL-12的能力,IFN-γ能增強編碼p40和p35的基因的轉錄,它對異源二聚體的產生具有特別明顯的效應,在炎症和Th1應答中,IFN-γ與IL-12生成的能力形成正反饋機制。IL-4、IL-10、IL-13、轉化生長因子β(TGF-β)是IL-12產生的有效抑制劑[5]。IL-4和IL-13對P40的表達具有雙重效應:在早期它們抑制P40的產生,在晚期卻有很強的增強作用。IL-10通過誘導一種尚未明確的蛋白的合成來阻斷兩個編碼基因的轉錄,前列腺素E2也是IL-12生成的抑制劑,在調節炎症性應答和IFN-γ產生時,和IL-12相關的另外一個細胞因子TNF也能抑制IL-12的產生。
生物學功能
儘管IL-12也作用於其他類型的細胞,但其主要作用於淋巴細胞,IL-12是Th1細胞免疫應答的決定因素,可有效地促進Th1類細胞因子如IFN_γ的產生,另一方面又可抑制Th2類因子如IL-4、IL-13的產生,從而抑制Th2型應答反應。IL-12的減少或缺失導致Th2優勢免疫反應。另外,IL-12能誘導多種細胞因子的產生,如INF_γ、IL-10等。IL-
12是最為強的誘導T淋巴細胞特別是活化的T細胞和NK細胞產生IFN_γ的細胞因子,IL-12的許多體內作用就是通過誘導IFN-γ的產生來發揮的。IL-12生物學活性的發揮是通過T細胞和NK細胞上的IL-12受體介導的。當NK
細胞、CD4+、CD8+的T細胞被活化後在其細胞表面上能表達出高親和力的IL-12受體(IL-12R),目前已在植物凝集素(PHA)活化的人外周血單個核細胞(PBMC)中檢測到表達兩個IL-12R亞單位(IL-12Rβ1和IL-12Rβ2)的克隆。IL-12和IL-12Rβ2結合,通過JAK2(Janus酪氨酸激酶)/STAT4(signaltransducerandactivat
oroftranscriptionprotein4)途徑增加了IFN_γ的產生。此外,在小鼠體內觀察到IL-12還能夠誘導IL-10的產生,並且作為一種協同刺激因子在體外能活化人的T淋巴細胞產生IL-10。由於IL-10能夠抑制IL-12的產生
和合成,並使IL-12的作用降低,故認為IL-12所誘導的IL-10的產生很可能是這種細胞因子限制其自身反應的一種負反饋調節機制。IL-12還能增強細胞毒性T淋巴細胞(CTLs)和LAK細胞的生成,同時,通過誘導編碼細胞毒顆粒相關分子基因的轉錄和通過上調黏附分子的表達,它也能增加CTLs和NK細胞的細胞毒活性。IL-12還能直接影響B細
胞的增殖、分化和IFN_γ產生,對B細胞的活化作用和誘導特定免疫球蛋白同種型(IgG增加,IgE減少)生成的效應。IL-12還通過IFN_γ的作用而抑制TGF-β的產生。由此可以看出,IL-12及其所誘導的細胞因子與其他細胞因子之間的相互作用是一個比較複雜的網路系統,它們之間相互作用而調節機體細胞之間的相互平衡,以利達到相應的應答水平。
醫學套用
與哮喘 IL-12具有調節Th1/Th2細胞免疫應答的作用,種細胞因子的減少或缺失導致Th2細胞的優勢分化,誘發哮喘發生。因此深入研究IL-12在哮喘中的發病機制,有可能哮喘的防治提供新思路。
與哮喘
支氣管哮喘是一種慢性氣道炎症性疾患,其病因和發病機制十分複雜,涉及到遺傳、環境、行為、心理和機體免疫等諸方面。誘發哮喘的主要免疫因素包括:IgE、EOS及細胞因子等。最近,細胞因子白細胞介素-12(IL-12)被認為對哮喘的異常免疫起關鍵作用。研究表明這種關鍵性免疫調節細胞因子在哮喘患者中分泌減少,導致哮喘的發生。
4IL-12與哮喘
4IL-12與哮喘已有研究表明P40基因編碼位於與哮喘有關的染色體5q31-33位置,其基因的兩個多態性與哮喘不同的表型有關。哮喘患者血清IL-12水平顯著低於健康者,經變應原刺激後IL-12的生成量也顯著低於健康者,實驗證明IL-是Th1細胞產生的必需因子,能促使Th0細胞向Th1細胞分化,抑制其向Th2細胞分化,有利於控制變態反應的發生和發展。IL-12與IFN-α同時作用可促進Th0細胞內IL-12RmRNA的表達,增加了IL-12與IL-12R的結合。IL-12還可逆轉變應原對IL-12RmRNA的抑制,同樣增加IL-12與IL-12R的結合。Naseer等[11]觀察到,過敏性哮喘 患者氣道活檢組織中IL-12mRNA的表達較正常人組織的表達水平顯著降低,用類固醇治療激素敏感性哮喘後能夠顯著增加氣道活檢組織IL-12陽性細胞的量,IL-12表達水平的升高與同期IL-13表達水平的下降是相聯繫的,而對激素非敏感性哮喘則不能表現出IL-12陽性細胞數量的增加。採用全血細胞培養,觀察其PBMC細胞因子的產生情況及其對IL-12的應答能力,發現過敏性哮喘患者IL-12的產生顯著低於正常人,表明IL-12產生缺陷是與過敏性氣道疾病相聯繫的。但哮喘患者IL-12減少的機制還不清楚,一方面考慮可能由細胞因子亞單位基因編碼改變所致,另一方面考慮可能與IL-12周圍具有負調節作用的細胞因子及介質影響有關,例如IL-10及組胺、前列腺素E2(PGE2)、TGF-β、IL-4、IL-13等。但關於IL-10的作用目前尚缺乏足夠的證據。
IL-12是促進Th1反應和IFN_γ生成以及下調IgE產生的重要調節因子,Lee等[12]研究小鼠模型腹膜內注射IL-12後發現IFN_γ、IgG產生增加,IgE、IL-5及嗜酸細胞浸潤減少。另有研究[13]發現變應性哮喘患者IL-12、IFN_γ水平降低,導致阻止IgE合成及減輕過敏性炎症反應的能力下降。IL-12的缺失導致Th1反應的減弱,最近在小鼠模型研究中發現IL-12的缺失及Th1反應的減弱是由於IL-12受體β2鏈基因表達改變所致。Wright等[14]的研究中,在變應性鼻炎患者活檢組織中IL-12的產生和IL-12Rβ2的表達比正常對照者減少,這些患者經類固醇治療後可以逆轉對IL-12的抑制,但不能恢復IL-12Rβ2的表達。Gately等[8]採用IL-12p40缺陷型小鼠(IL-12p40-/-)研究了IL-12對過敏性氣道炎症反應調節的生理學功能,採用卵白蛋白(OA)免疫IL-12p40-/-小鼠後14~20天,用含有OA的氣溶膠進行刺激,結果氣道發生以嗜酸粒細胞浸潤為主的炎性反應,並伴有氣道灌洗液中IL-4、TFN_α水平及血清IgE水平的升高。若在氣溶膠中加入抗IL-4或TFN-α/IL-4的抗體,則這種嗜酸粒細胞的炎症反應就被顯著地抑制。這表明IL-12可能通過調節IL-4和TFN-α的產生在阻斷氣道的過敏性應答反應中發揮著重要的作用。
5IL-12與哮喘的治療
5IL-12與哮喘的治療IL-12能調節Th1/Th2平衡,在哮喘中起重要作用,但IL-12不管作為哮喘直接的或輔助的治療都是有爭議的,為此Matsuse等[15]研究鼻內滴入IL-12作為佐劑在調節免疫反應、肺部特異性炎症及氣道反應性中的作用,發現小鼠模型中採用IL-12滴鼻可以促使體內Th2向Th1轉換,減輕肺部的炎症和氣道的高反應性。動物實驗[16]表明皮下注射rIL-12能降低小鼠外周血及唾液中嗜酸細胞計數,為哮喘的抗炎治療提供了重要依據。Sur[17]等在小鼠模型中黏膜(氣管內)和全身(腹膜內)給予IL-12作比較發現:氣管內及全身用藥兩者均能抑制哮喘中 嗜酸細胞肺浸潤,但氣管內用藥劑量低於全身用藥100倍,提示低劑量IL-12噴霧法抑制哮喘嗜酸細胞肺浸潤是有效的。哮喘的分子遺傳學顯示:哮喘是一種多基因參與的遺傳性疾病,因而運用DNA重組技術修復或調節細胞中有缺陷的基因,使細胞恢復正常功能。IL-12可誘導T細胞向Th1細胞方向轉化,Th1細胞產生的細胞因子IFN_γ可抑制Th2細胞因子的產生,因此轉入這些細胞因子的基因,使它們在體內表達,從而可達到治療哮喘的目的。Hogan等[18]用病毒載體向致敏小鼠氣道黏膜轉染IL-12基因後發現,IFN_γ表達增加,Th2細胞因子產生受到抑制,氣道反應性明顯減低,同時由於細胞介導免疫的建立,氣道的病毒感染很快得到控制。Lee等[19]向致敏小鼠的肺部轉入IL-12基因後發現能夠減輕氣道高反應性、嗜酸細胞浸潤,抑制Th2細胞因子的產生,這一發現表明局部轉基因治療能調節肺過敏反應,有可能為將來套用DNA疫苗治療哮喘提供一種安全可靠的方法。Leonard等[20]在小鼠模型中進一步研究發現,局部吸入IL-12能夠增強阻止過敏性炎症反應,在人體試驗中卻因副作用而終止,全身套用IL-12治療哮喘因其毒副作用而受到限制,目前的研究方向是模擬細菌DNA,體內注入CpGDNA序列,誘導IL-12產生,以減輕嗜酸細胞的浸潤和氣道高反應性。
綜上所述,IL-12是一種多功能細胞因子,具有廣泛的生物學活性,在哮喘發病機制中起重要作用,因此充分了解IL-12的生物學活性及其在哮喘發病中的機制,將有可能為以後哮喘的研究、治療提供新的思路和方法。
與惡性胸水
惡性胸水是晚期腫瘤患者的常見併發症,患者胸水控制的程度直接影響到患者的生存質量及整體療效。有效控制癌性胸水不僅可以減輕病人痛苦,改善生活質量,還可以為進一步治療創造條件。射頻熱療是採用高頻電磁場對人體進行透熱治療,具有非介入、無創傷、區域熱療等特點,不僅對腫瘤細胞有直接的熱細胞毒效應,同時對放化療增敏,提高人體免疫力的作用,是近年來腫瘤治療的重要手段之一。近來我們將白介素Ⅱ胸腔灌注聯合射頻熱療治療癌性胸水,取得較好結果。
資料與方法
1.1
臨床資料惡性胸水患者48例中,男29例,女19例;年齡21~70歲,中位年齡52歲;肺癌24例,食管癌11例,乳腺癌6例,惡性淋巴瘤5例,原發灶不明的腫瘤2例。所有患者治療前KPS評分≥60分,預計生存期≥2個月,血常規、肝腎功能及心電圖均在正常範圍。48例病例隨機分為治療組24例,對照組24例。
1.2
治療方法通過B超定位,確定胸水範圍和最低穿刺點後,在局麻下穿刺,首次抽胸水600~800ml,以後每次以患者耐受為原則,儘量抽盡胸水,再以白介素Ⅱ100萬U加生理鹽水40ml注入胸膜腔內,並囑患者變動不同體位,使藥物能均勻分布於胸腔。治療組以白介素Ⅱ灌注後1h內再進行胸部射頻熱療。射頻熱療採用HY-7000型射頻治療機,頻率40.68MHz,電容式加熱,選擇左右電極板,治療入射功率500~800W,反射功率控制在2%以內,反射功率調配在2%以內,熱療溫度(以腋前線與肋弓交接點的胸壁皮溫作為相對溫度進行評估)控制在38.0℃~39.0℃範圍,每次熱療持續時間60min。隔日熱療1次,6~8次/療程。對照組則只行白介素Ⅱ胸腔灌注,方法與劑量同治療組。兩組病例白介素Ⅱ胸腔灌注治療每3天重複1次,共4次。2周為一療程。治療期間每周進行B超檢查,1個月後評價療效。
1.3
統計學方法計數資料比較採用χ2檢驗,計量資料比較採用t檢驗。
1.4療效評定標準以胸部B超檢查結果,參照WHO規定的標準分為:完全緩解(CR):胸水消失,症狀緩解並持續1個月以上;部分緩解(PR):胸水顯著減少(50%以上),症狀緩解並持續1個月以上;穩定(SD):胸水減少(不足50%),無增加趨勢,症狀部分緩解;無效(PD):胸水無減少或增加,症狀加重。CR+PR為總有效率。
結果
兩組療效及其比較:治療組24例治療後CR19例,PR3例,SD1例,PD1例。對照組24例治療後CR10例,PR2例,SD8例,PD4例。治療組和對照組的近期總有效率分別為91.67%和50%。治療組的療效顯著優於對照組,兩組的比較差異具有顯著性。
討論
白介素Ⅱ主要是輔助性T細胞產生的一種細胞因子,也稱T細胞生長因子,具有多種生物活性,如促進T細胞生長、增殖,並誘導產生LAK細胞和TIL細胞,激活NK細胞、細胞毒性T淋巴細胞(CTL)等,還能誘導產生干擾素(IFN)、腫瘤壞死因子(TNF)和細胞集落刺激因子(CSF),並與其協同增強NK細胞活性。
熱療是惡性腫瘤綜合治療方法之一,它通過特定設備加熱使腫瘤組織上升到有效治療溫度,使腫瘤縮小或消除,又不損傷正常組織的一種新型治療方法。
將白介素Ⅱ胸腔注射與局部射頻熱療相結合,治療48例癌性胸水患者,總有效率達77.27%。較單獨套用白介素Ⅱ胸腔注射治療惡性胸水明顯提高。
由此可見,局部射頻熱療可提高白介素Ⅱ胸腔灌注對胸水的控制效果,且副作用較小,不失為治療惡性胸腔積液的一條新途徑。