化合物介紹
1、代表物質
環氧乙烷(氧化乙烯)、環氧丙烷(氧化丙烯)、1,2-環氧丁烷(氧化丁烯)、1,4-環氧丁烷(四氯呋喃)、環氧氯丙烷(表氯醇)、1,4-二氧六環等。
2、物質特性
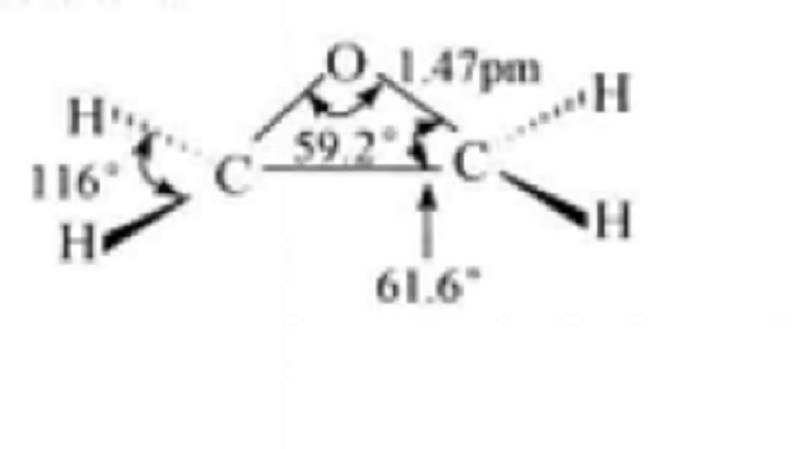
環氧化合物是指含有C2O基團的三元環化合物,是一種環醚。環氧乙烷是三元環醚,是一種最簡單的環醚,其環容易打開,不作溶劑使用。低碳數環氧化合物多是液體,溶於水、醇、醚等。
3、配伍禁忌
(1)環氧化合物在空氣中可燃燒,其蒸氣與空氣可形成爆炸性氣體混合物。
(2)環氧化合物與硫酸、硝酸等接觸會發生爆炸。
(3)環氧化合物與共價鹵化物(如三氯化鋁)和金屬氧化物接觸會發生爆炸性聚合
(4)環氧化合物與無機鹼、氨、有機胺、金屬鉀等接觸,發生劇烈聚合反應。
(5)環氧化合物與金屬烷氧化物(如叔丁基醇鉀)接觸會發生著火。
(6)環氧化合物與高氯酸鎂接觸,可能因生成高氯酸酯而導致爆炸。
(7)環氧化合物在鹵離子催化下,可能因生成二氯乙炔,而導致爆炸。
(8)環氧化合物與醇(如甘油)在加熱時,可能因發生失控反應而導致爆炸。
常見物質
1、環氧乙烷
又稱氧化乙烯、1,2.環氧乙烷、二氫環氧乙烯。閃點-28.9℃。與空氣混合形成爆炸混合物。與胺、氨、鉀、共價氫化物接觸發生爆炸性聚合反應,反應具危險性。接觸高活性催化表面(無水鐵、錫、鋁氯化物、純鐵、鋁氧化物、氫氧化鈉)發生劇烈化學。重排或聚合放熱反應。少量強酸、鹼金屬、氧化劑也能引起反應。避免接觸銅、鎂、汞、銀及其合金(包括焊料),防止形成爆炸性乙炔化金屬。
防止容器損壞、受熱、光照。在絕緣體中可反應並生成聚乙二醇,自發生熱並在<100℃點燃。與強氧化劑、醇、鋁、胺、丙三醇、五氧化二氮、間硝基苯胺劇烈反應;與溴乙烷、高氯酸鎂、硫醇、鹽類、鏈烷硫醇、易燃物等不相容。導電性低,流動或攪動會產生靜電。浸蝕某些橡膠、塑膠和棉織品。
2、環氧丙烷
又稱氧化丙烯、甲基環氧乙烷、1,2-環氧丙烷、2,3-環氧丙烷。閃點-37.0℃。與空氣或氧混合形成爆炸混合物。與酸、苛性鹼、全鹵化物發生危險性聚合;與水、水蒸氣反應能形成不穩定過氧化物。與酸、氨、胺、乙炔化金屬、黏土基吸收劑發生反應;與無水金屬氯化物、氫氧化銨、鹽類不相容。導電性低,流動或攪動會產生靜電,並可能引燃其蒸氣。浸蝕某些橡膠、塑膠和棉織品。
開環及機理
環氧化合物在酸或鹼催化下可與多種試劑發生反應而開環。現以環氧乙烷為例,其主要反應如下:
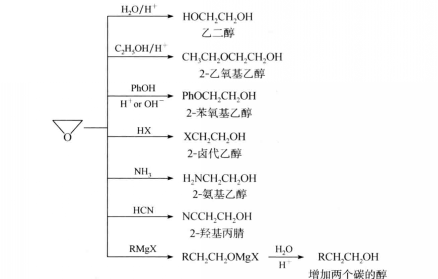 反應方程式
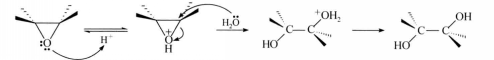
反應方程式上述開環反應被認為是按SN2機理進行的,現以水解反應為例來說明在酸或鹼催化下開環反應的機理。
酸性條件下,氧首先質子化,使碳氧鍵極性增強,有利於親核試劑的進攻。親核試劑從環的反方向進攻得到相應反式開環產物。
 反應方程式
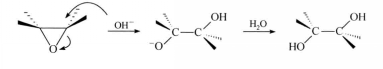
反應方程式鹼性條件下,雖然環氧烷不是最活潑的形式,但親核試劑的親核能力較強,同樣會發生開環反應,亦得到反式開環產物。而一般醚在鹼性條件下則不發生此反應。
 反應方程式
反應方程式開環反應方向
對稱環氧化物發生開環反應時,無論
親核試劑進攻哪一個碳原子,所得產物均相同。但是,當不對稱的環氧化合物進行
開環反應時,可能會得到兩種產物。兩種產物中哪一種占優勢,就存在開環反應的方向問題。
在鹼性條件下,親核試劑進攻
位阻較小的碳原子(連有最少取代基的碳原子)。
例如:
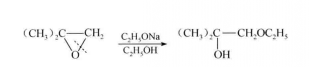 反應方程式
反應方程式在酸性條件下開環,親核試劑主要進攻連取代基較多的碳原子。例如:
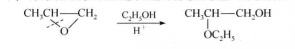 反應方程式
反應方程式在酸催化下,由於質子化的環氧化合物活性較高,離去基團較好,而所用試劑的親核能力又較弱;因此,反應中C一C鍵的斷裂先於親核試劑與環碳原子之間鍵的形成,使該SN2反應具有SN1的性質。當帶有部分正電荷的環碳原子上連有較多取代基(一般為烷基)時,該環碳原子能容納較多的正電荷,故親核試劑優先進攻連有較多取代基的環碳原子。
立體化學
如前所述.無論在酸性條件下還是在鹼性條件下。環氧烷的開環反應,均是按S
N2機理進行,所以親核試劑總是從
離去基團(氧橋)的背面進攻中心碳原子,得到反式開環產物。若中心碳原子為手性碳原子,則導致中心碳原子構型轉變。例如:
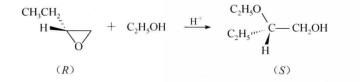 反應方程式
反應方程式 反應方程式
反應方程式 反應方程式
反應方程式 反應方程式
反應方程式 反應方程式
反應方程式 反應方程式
反應方程式 反應方程式
反應方程式