基本介紹
- 中文名:玻爾理論
- 外文名:Bohr Theory
- 提出者:玻爾
- 提出時間:1913年
- 套用學科:物理
- 適用領域範圍:結構化學
理論基礎,基本假設,意義與局限性,
理論基礎
玻爾理論的基礎是普朗克(M. Planck) 的量子論和愛因斯坦的光子學說。1900年 ,普 朗克在研究黑體輻射問題時,提出了著名的量子化理論。該理論指出,物質吸收和發射能量是不連續的。也就是說,物質吸收和發射能量,就像物質微粒一樣,只能以單個的、一定 分量的能量,一份一份地或按照這一基本分量的倍數吸收或發射能量 , 即能量是量子化 的。這種能量的最小單位叫能量子,簡稱量子。1905年,愛因斯坦(A. Einstein)引用普朗克的 量子論並加以推廣,用於解釋光電效應,提出了光子學說。當能量以光的形式傳播時,其最小 單位是光量子(簡稱光子),實驗證明,光子的能量與光的頻率成正比。能量 及其他物理量的不連續性是微觀世界的重要特徵。
基本假設
玻爾在氧原子和類氫原子(即原子核核外只有一個電子的,如  、
、 等 )的光譜 以及普朗克的量子論、愛因斯坦的光子學說的基礎上,提出了原子結構理論的幾點假設。
等 )的光譜 以及普朗克的量子論、愛因斯坦的光子學說的基礎上,提出了原子結構理論的幾點假設。


- 核外電子只能在某些特定的(有確定的半徑和能量)圓形軌道上繞核運動,電子在 這些符合量子化條件的軌道上運動時,處於穩定狀態,這些軌道的能量狀態不隨時間而改 變 ,因而被稱為定態軌道。在定態軌道上運動的電子既不吸收能量,也不放出能量。
- 電子在不同軌道上運動時,其能量是不同的。軌道離核愈遠,能量愈高。當原子中 的電子處於離核最近的軌道時,它們處於最低的能量狀態,稱為基態。當原子從外界獲得 能量時,電子可以躍遷到離核較遠、能量較髙的軌道上,這種狀態稱為激發態。電子的能 S量是量子化的,它不可能處於兩個允許的相鄰軌道的能量之間。
- 電子在能量不同的軌道之間躍遷時,原子才會吸收或放出能量。處於激發態的電 子不穩定,可以躍遷到離核較近的軌道上,同時釋放出光能。釋放出光能(光的頻率)的 大小決定於兩軌道之間的能量差,其關係式為:

式 中  為 髙 能 級 的 能 量 ;
為 髙 能 級 的 能 量 ;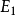 為 低 能 級 的 能 量 。
為 低 能 級 的 能 量 。

意義與局限性
玻爾理論不但回答了氫原子穩定存在的原因,而且還成功地解釋了氫原子和類氫原 子的光譜現象。氫原子在正常狀態時,核外電子處於能量最低的基態,在該狀態下運動的 電子既不吸收能量,也不放出能量,電子的能量不會減少,因而不會落到原子核上,原子不 會毀滅。當氫原子從外界獲得能量時,電子就會躍遷到能盤較高的激發態,處於激發態的 電子不穩定,就會自發地躍遷回能量較低的軌道,同時將能量以光的形式發射出來。由於 兩個軌道即兩個能級間的能量差是確定的,且軌道的能量是不連續的,所以發射出光的頻 率有確定值,而且是不連續的,因此得到的氫原子光譜是線狀光譜。
但是 ,玻爾的原子模 型卻無法說明多電子原子的光譜,甚至不能說明氫原子光譜的精細結構。也就是說,玻爾 理論雖然引用了普朗克的量子化概念,卻沒有跳出經典力學的範圍。而電子的運動並不 遵循經典物理學的力學定律,而是具有微觀粒子所特有的規律性——波粒二象性,這種特 殊的規律性是玻爾在當時逕沒有認到的。
 玻爾
玻爾
