基本介紹
- 中文名:原子模型
- 外文名:Atom model
- 提出者:約翰·道爾頓
- 提出時間:1803年
- 套用學科:物理、化學等
- 基本組成:原子核和核外電子
概述
發展歷程
道爾頓原子模型
(2)化合物是由兩種成兩種以上元素的原子組成的,在化合物中,任意兩種元素的原子數之比不是一個整數就是一個簡單的分數;
(3)化學反應就是不同原子的分離、結合成重新組合,而沒有原子的創生或消失。
湯姆孫原子模型
盧瑟福的含核原模型
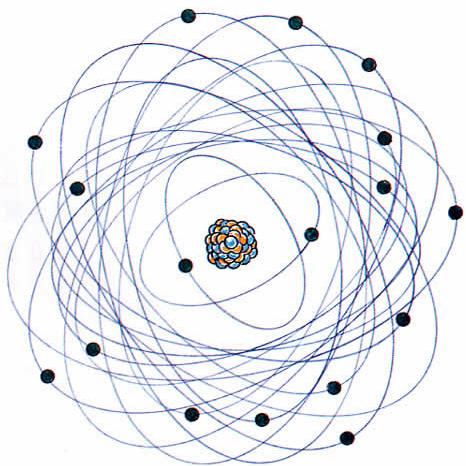
玻爾原子模型
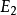




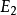

原子結構(也可稱為原子模型)是指原子的構成組成以及部分的搭配和安排。原子非常小,以碳(C)原子為例, 其直徑約為140pm(皮米),但通常以半徑記錄,在以毫米(mm)...
原子結構模型發展是指從1803年道爾頓提出的第一個原子結構模型開始,經過一代代科學家不斷地發現和提出新的原子結構模型的過程。...
原子模型是人們對物質世界微觀結構的認識而建立的模型。目前人們普遍接受的原子模型為由原子核(質子和中子)和電子構成,電子繞核做不規則運動,形成的電子云模型。原子...
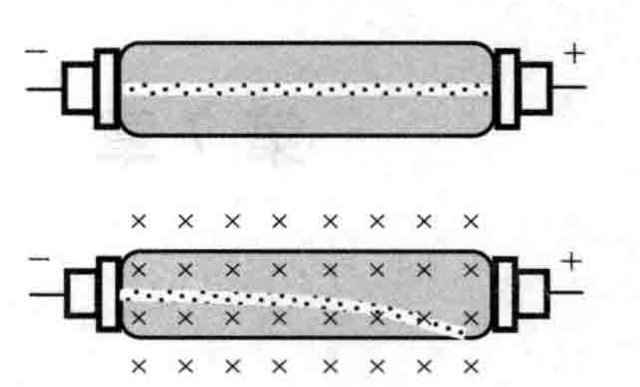
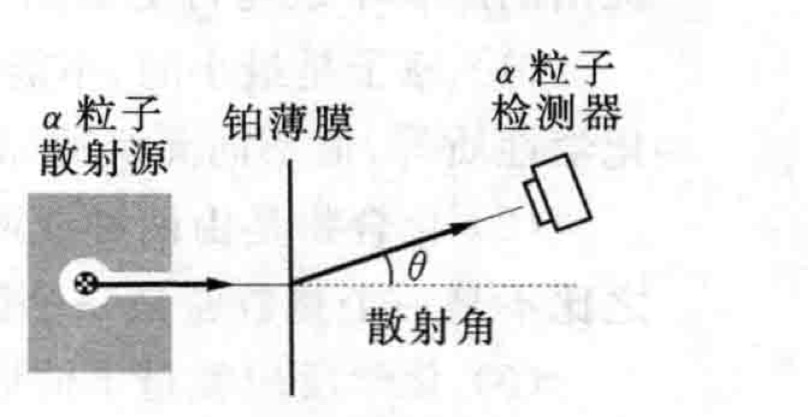
盧瑟福原子模型 又稱“有核原子模型”、“原子太陽系模型”、“原子行星模型引”。關於原子結構的一種模型。1911年由盧瑟福提出。認為原子的質量幾乎全部集中在直徑...
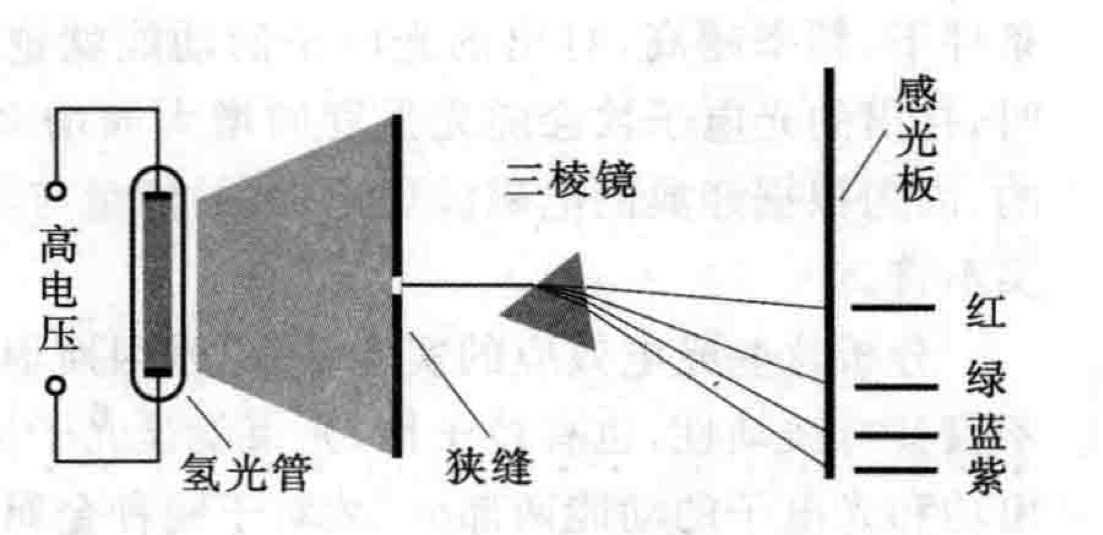
尼爾斯·玻爾(Niels Bohr,1885-1962),在盧瑟福模型的基礎上,他提出了電子在核外的量子化軌道,解決了原子結構的穩定性問題,描繪出了完整而令人信服的原子結構學說...
盧瑟福的理論吸引了一位來自丹麥的年輕人,他的名字叫尼爾斯·玻爾(Niels Bohr,1885-1962),在盧瑟福模型的基礎上,他提出了電子在核外的量子化軌道,解決了原子結構...
能級圖如左圖所示原子各能級的關係為:En=E1/n2(n=1,2,3,...)氫原子的基態能量:E1=-13.6 eV...
“葡萄乾蛋糕”又稱“棗糕模型”,也稱“葡萄乾麵包”,是科學家湯姆森提出的原子結構模型。此模型曾在一段時間內受到學界廣泛的認可,並能對原子的電中性的,電子在...
氬原子模型是一個物理模型。...... “氬原子模型”剖面圖 對該模型的結構解析如下:1. 球面結構。在傳統傳播模式中,一家報紙、一個廣播電台或一個電視台的傳播...
1903年,湯姆森在發現電子的基礎上提出了原子結構的“葡萄乾布丁”模型,開始涉及原子內部結構。...
原子結構示意圖是表示原子核電荷數和電子層排布的圖示形式。小圈和圈內的數字表示原子核和核內質子數,弧線表示電子層,弧線上的數字表示該層的電子數。...
原子(atom)指化學反應不可再分的基本微粒,原子在化學反應中不可分割。但在物理狀態中可以分割。原子由原子核和繞核運動的電子組成。原子構成一般物質的最小單位,...
原子論是指關於原子概念的學說。德謨克利特探討了物質結構的問題,提出了原子論的思想。他認為萬物的本原是原子和虛空。原子是一種最後的不可分割的物質微粒,它的...
殼層模型是模擬原子內結構的結構模型。...... 核殼層模型部分是類似於原子的電子殼層描述原子中的電子的安排,當殼層填滿時特別穩定,核殼層模型描述原子中次原子粒子的...
《3D原子結構圖》是一款應用程式,運行環境支持Android1.5。...... 圖集 3D原子結構圖圖冊 V百科往期回顧 詞條統計 瀏覽次數:次 編輯次數:3次歷史版本 最近更新:...
原子能級是指原子系統能量量子化的形象化表示。按照量子力學理論,可計算出原子系統的能量是量子化的,能量取一系列分立值;能量值取決於一定的量子數,因此能級用一定...
關於原子內電子排布的一種簡化模型。...... 關於原子內電子排布的一種簡化模型。中文名 原子殼層結構 外文名 atomic shell structure 目錄 1 原子殼層結構含義 2 ...
