熱效應總值一定定律也被稱為蓋斯定律。若一反應為二個反應式的代數和時,其反應熱為此二反應熱的代數和。也可表達為在條件不變的情況下,化學反應的熱效應只與起始和終了狀態有關,與變化途徑無關。它是由瑞士化學家蓋斯發現並用於描述物質的熱含量和能量變化與其反應路徑無關。
基本介紹
- 中文名:熱效應總值一定定律
- 外文名:Law of total heat effect
- 學科:材料工程
- 領域:工程技術
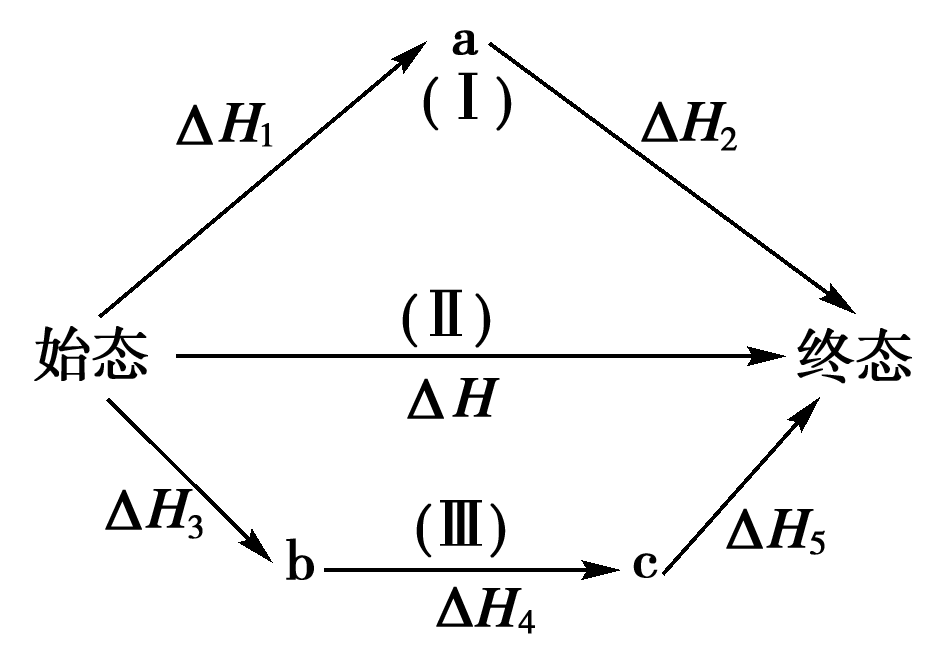
熱效應總值一定定律也被稱為蓋斯定律。若一反應為二個反應式的代數和時,其反應熱為此二反應熱的代數和。也可表達為在條件不變的情況下,化學反應的熱效應只與起始和終了狀態有關,與變化途徑無關。它是由瑞士化學家蓋斯發現並用於描述物質的熱含量和能量變化與其反應路徑無關。
熱效應總值一定定律也被稱為蓋斯定律。若一反應為二個反應式的代數和時,其反應熱為此二反應熱的代數和。也可表達為在條件不變的情況下,化學反應的熱效應只與...
蓋斯定律 表達式 反應熱的總值相等 提出者 赫斯 提出時間 1840年 套用學科...其反應熱是相同的,總反應方程式的焓變等於各部分分布反應按一定係數比加和的焓變...
表述形式:熱量可以從一個物體傳遞到另一個物體,也可以與機械能或其他能量互相轉換,但是在轉換過程中,能量的總值保持不變。其推廣和本質就是著名的能量守恆定律。 ...
反應焓變計算的主要依據是熱化學方程式、蓋斯定律等相關數據。反應焓變套用技巧 ...化學反應的熱效應只與始態、終態有關,與反應過程無關,反應熱總值一定。如下...
二是研究在一定條件下,化學反應進行的方向和限度,這可由熱力學第二定律來解決...總數量不變”,換言之,即“在孤立體系中,能的形式可以轉化,但能量的總值不變...
功時,不論是一步完成的還是幾步完成的,其熱效應總是相同的(反應熱的總值相等...赫斯定律的建立,使得熱化學方程式可以向普通代數方程式一樣進行計算,有很大的實用...
功時,不論是一步完成的還是幾步完成的,其熱效應總是相同的(反應熱的總值相等...”這叫作蓋斯定律。換句話說,化學反應的反應熱只與反應體系的始態和終態有關...
功時,不論是一步完成的還是幾步完成的,其熱效應總是相同的(反應熱的總值相等...赫斯定律的建立,使得熱化學方程式可以向普通代數方程式一樣進行計算,有很大的實用...
