煉鋼脫碳反應是在煉鋼時鋼液中的碳與氧化合生成CO而被脫除的物理化學過程。脫碳反應可以分成3個環節:(1)氧通過渣層的傳質及鋼液內碳和氧的傳質;(2)碳和氧的化學反應;(3)CO向氣相逸出。
基本介紹
- 中文名:煉鋼脫碳反應
- 外文名:decarbonization in steelmaking
- 學科:冶金工程
- 套用領域:鋼鐵冶煉
- 作用:脫出剛液中的碳
- 過程:3個環節
介紹
反應方式
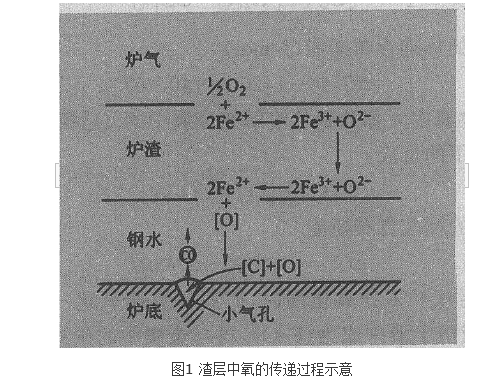
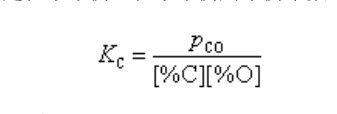

煉鋼脫碳反應是在煉鋼時鋼液中的碳與氧化合生成CO而被脫除的物理化學過程。脫碳反應可以分成3個環節:(1)氧通過渣層的傳質及鋼液內碳和氧的傳質;(2)碳和氧的化學反應;(3)CO向氣相逸出。


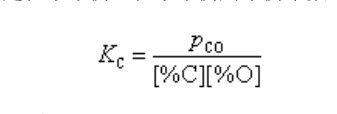

煉鋼脫碳反應是在煉鋼時鋼液中的碳與氧化合生成CO而被脫除的物理化學過程。脫碳反應可以分成3個環節:(1)氧通過渣層的傳質及鋼液內碳和氧的傳質;(2)碳和氧的...
因此在煉鋼過程通過氧化去除多餘的碳。鋼的性質與其含碳量有關,為達到所煉鋼種的適宜含碳量及適宜的澆注溫度,必須研究煉鋼脫碳反應機理。...
脫碳反應是電爐煉鋼過程中最重要的化學反應,脫碳反應在煉鋼過程的主要作用如下:(1)脫碳反應的熱效應是最主要的化學反應熱,為電爐煉鋼提供了必要的化學熱。...
煉鋼爐渣 (steelmaking slag)是指煉鋼過程金屬料(鐵水和廢鋼等)中的雜質被氧化劑氧化而生成的氧化物再與造渣劑和爐襯發生物理化學反應而形成的產物的總稱。爐渣密度...
134 為什麼脫碳是煉鋼過程的主要任務,其氧化的特點是什麼?135 脫碳反應對煉鋼過程有什麼作用?136 爐渣返乾會出現什麼樣的火焰特徵?137 熔渣出現噴濺時會有哪些火焰...
轉爐煉鋼碳含量達到要求值時立即停止供氧的操作。碳含量控制是轉爐煉鋼終點控制的主要內容之一。由於冶煉過程的脫碳反應速度快,準確判斷接近終點時的鋼中碳含量,及時...
78.復吹對脫碳反應有何影響? 79.復吹對脫磷反應有何影響? 80.復吹對鋼中氧含量有何影響? 81.煉鋼過程中主要排放哪些固體廢棄物? 82.為什麼必須重視對煉鋼所...
《煉鋼原理》是2011年中國勞動社會保障出版社出版的圖書,該書作者是人力資源和...第六章 碳氧反應第一節 碳氧反應熱力學第二節 脫碳反應動力學分析...
2.氧氣轉爐煉鋼的發展與前景 3.氧氣轉爐技術的發展 4.現代鋼鐵工業工藝流程 第2章 轉爐煉鋼的物理化學 1.氧化反應和氧勢 2.脫碳反應 3.脫硫 4.脫磷 5.脫氧...
轉爐雙聯法煉鋼工藝,即採用一座轉爐進行鐵水脫磷,另一座轉爐脫碳和提溫,兩座轉爐雙聯組織生產,以達到有效改善鋼的質量和縮短冶煉周期的目的。工藝路線:高爐鐵水...
造渣:調整鋼、鐵生產中熔渣成分、鹼度和粘度及其反應能力的操作。目的是通過 ...氧化期和脫碳期:普通功率電弧爐煉鋼的氧化期,通常指爐料溶清、取樣分析到扒完...
203. 脫碳主要依靠什麼方式完成,氧氣直接和鋼中碳反應的幾率大嗎?204. 電爐煉鋼的供氧方式主要有哪幾種?205. 爐門自耗式氧槍的使用情況是怎樣的,有何優缺點?...
轉爐煉鋼終點控制(end point control of converter steelmaking)是控制轉爐煉鋼過程...氧流量、底部吹氣量和加料的變化對吹煉過程的脫碳和成渣反應的影響,以便確定...
頂底復吹轉爐煉鋼熔池攪拌 在復吹轉爐中,攪拌熔池的動力來源有頂吹氧、底吹氣體和碳氧反應沸騰三者。除碳氧反應的攪拌力決定於脫碳速率外,頂吹和底吹的攪拌力...
在一般的煉鋼方法中,為了清除鋼液中的氣體和夾雜物,是利用脫碳反應形成的鋼液沸騰,而為此就需要使鋼液強烈氧化,而下一步為了除去鋼液中殘留的大量的氧[FeO],...
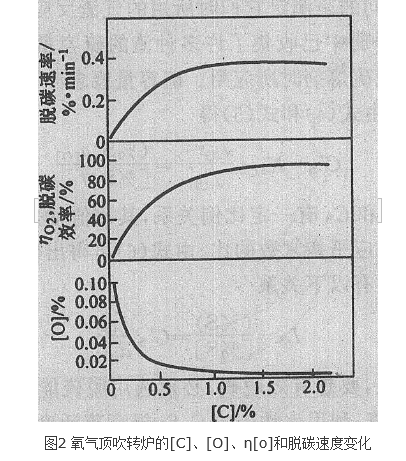
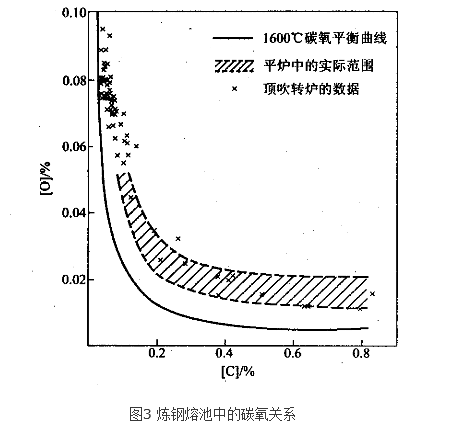
氧氣頂吹轉爐煉鋼的脫碳反應,由鋼液中的反應方程式【C】+【O】→CO來看,似應為二級反應,但實驗表明,此反應相當複雜,其反應級數隨冶煉階段而變化(表1)。由於...
氧化法是電弧爐煉鋼的傳統操作方法。電爐煉鋼主要利用電弧熱,在電弧作用區,溫度...脫碳反應開始,一般要求脫碳量在0.3%~0.4%左右,脫碳速度要均勻,保持在0.01%...
供氧工藝參數是轉爐煉鋼的重要參數,包括供氧壓力、供氧強度、噴頭結構和氧槍高度控制等,它影響著鋼水的攪拌程度、脫碳速度、升溫速度、造渣速度、渣中TFe含量及磷分配...
RH法的脫碳及脫硫速率[J]. 煉鋼, 2000, 16(2):57-62. 2. 周文英, 周子華, 區鐵. RH法的冶金反應[C]// 全國冶金工藝理論學術會議. 1999. 3. ...
LWS法(LWS process)即氧氣底吹轉爐煉鋼,由轉爐頂部垂直插入的氧槍將工業純氧吹...噴濺和返乾時有發生,而且吹煉後期熔池的攪拌弱(主要靠脫碳反應攪拌),鋼渣間...
