通過比較C-O單鍵和C=O雙鍵的鍵能,預測醇的共軛鹼很容易通過無鍵共振形成C=O雙鍵。由於C-C鍵能遠小於C-H鍵能,所以甲基比氫原子更容易通過形成無鍵共振來穩定烷氧基負離子,由此導致氣相中的酸性順序為:(CH3)3COH>(CH3)2CHOH>CH3CH2OH>CH3OH。這個觀點得到了量子化學計算的支持。
基本介紹
- 中文名:無鍵共振
- 作用:穩定烷氧基負離子
- 比較:鍵能
- 舉例:氣相中醇的酸性順序
- 領域:有機化學
簡介,從無鍵共振看氣相中醇的酸性順序,乙氧基負離子的無鍵共振,
簡介
醇在氣相中的酸性順序是:(CH3)3COH>(CH3)2CHOH>CH3CH2OH>CH3OH。由於化合物酸性大小取決於其共軛鹼的穩定性,所以上述酸性順序可轉化為其共軛鹼穩定性的順序:(CH3)3CO->(CH3)2CHO->CH3CH2O->CH3O-。目前國內的有機化學教科書均以甲基(或其他烷基)是吸電子基來解釋上述的共軛鹼穩定性順序。這一解釋是正確的,但是如何理解甲基是吸電子基卻不是一件容易的事。
從無鍵共振看氣相中醇的酸性順序
甲基在與碳正離子、苯環和雙鍵等官能團相連時都表現出明顯的給電子效應,所以在絕大多數電子效應的討論中,都將甲基歸類為給電子基團,如取代苯定位規律、取代烯烴親電加成活性、羧酸酸性和醛酮親核加成活性等。因此說甲基是吸電子基不易被接受。
甲基與碳正離子、苯環和雙鍵等官能團相連時,存在著超共軛效應,因此體現給電子效應; 與氧負離子相連時,沒有超共軛效應,因此體現吸電子效應。這個解釋雖然從總體上解決了不少困惑,但並不是很完善。
例如,在甲胺中,甲基與氮原子也沒有明顯的超共軛效應,但甲胺的鹼性大於氨,此時甲基顯然體現了給電子效應。因此,需要進一步探討甲基在哪些情況下體現吸電子效應。
有一個數據對於理解上述的烷氧基負離子的鹼性順序很有幫助,即碳氧單鍵和碳氧雙鍵的鍵能數據。在機械工業出版社出版的美國大學優秀教材《Organic Chemistry》第7版中,列出C-O的鍵能為381kJ/mol,C=O的鍵能為745kJ/mol。這說明碳氧π鍵的鍵能約364kJ/mol,遠遠高於碳碳π鍵的鍵能(約265kJ/mol),表明氧傾向於與碳形成雙鍵。因此可以預測烷氧負離子存在如圖1所示的無鍵共振(以乙氧基負離子為例) 。
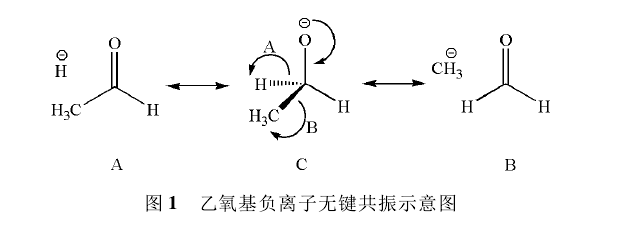 乙氧基負離子
乙氧基負離子乙氧基負離子的無鍵共振
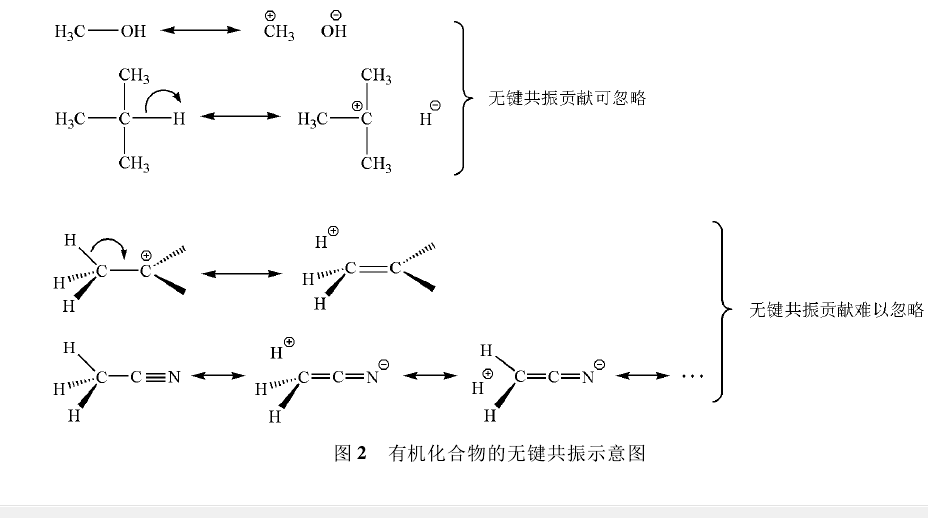
在圖1的共振結構(A和B) 中,由於σ鍵破裂而使氫負離子和甲基負離子與分子中其餘部分不存在共價鍵結合,呈現無鍵狀態,這種共振稱為無鍵共振。無鍵共振涉及σ鍵的成鍵和斷鍵兩種共振式,由於σ鍵鍵能大的緣故,通常成鍵的共振式要比斷鍵的共振式穩定得多,所以無鍵共振的貢獻在多數情況下不明顯。
但是當σ鍵破裂的能量損失能夠因π鍵形成或者離域體系加大而得到補償的話,則無鍵共振的貢獻可以明顯加大。
這種無鍵共振可以解釋甲基是給電子基和碳正離子容易甩β-H成烯這兩個事實; 在乙腈的共振結構中,C-H鍵的破裂因Π43的生成而得到部分補償,所以共振論提出者鮑林指出無鍵共振對乙腈結構的貢獻度合起來約占20% 。同理,在圖1所示的共振結構中,C-H σ鍵和C-C σ鍵破裂的能量損失可以由C-O π鍵的生成而得到補償,因此預測烷氧基負離子存在無鍵共振是合理的。
由於C-H的鍵能(約410kJ/mol)遠大於C-C鍵能(約365kJ/mol) ,所以圖1中B的貢獻大於A,即甲基由於具有較小的鍵能(C-C鍵能小)而比氫原子(C-H鍵能大) 更容易分散烷氧基負離子的負電荷,因此成為吸電子基。
很明顯,甲基越多,無鍵共振效應越大,負離子越穩定,因此不同的烷氧基負離子有如下的穩定順序: (CH3)3CO->(CH3)2CHO->CH3CH2O->CH3O-。