該理論認為,凡在溶劑中產生(或通過反應生成)該溶劑的特徵陽離子的溶質稱作酸,如酸的水溶液、液氨中的銨鹽等;而產生(或通過反應產生)該溶劑的特徵陰離子的溶質稱作鹼,如氫氧化鈉的水溶液、液氨中的氨基化鈉 NaNH2等。
基本介紹
- 中文名:溶劑體系理論
- 特徵:陰離子的溶質稱作鹼
- 優點:擴展到完全不涉及質子的溶劑體系
- 溶劑的特徵:陽離子的溶質稱作酸
特徵,優點,
特徵
與水相似,許多溶劑能自電離,形成特徵的陽離子和陰離子: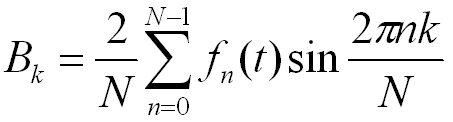
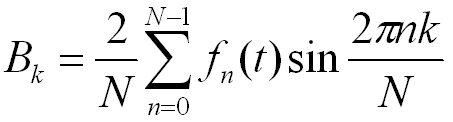
H.卡迪和H.P.埃爾西提出的溶劑體系理論時對阿累尼烏斯的電離理論及布朗斯特的質子理論的進一步發展,把酸鹼概念擴展到完全不涉及質子的溶劑體系中。該理論認為,凡在溶劑中產生(或通過反應生成)該溶劑的特徵陽離子的溶質稱作酸,如酸的水溶液、液氨中的銨鹽等;而產生(或通過反應產生)該溶劑的特徵陰離子的溶質稱作鹼,如氫氧化鈉的水溶液、液氨中的氨基化鈉 NaNH2等。
(注:① "←→" 表示可逆符號,下同。)
在水中,NH3是鹼,CH3COOH是酸
NH3 + H20 ←→ NH4+ + OH-(鹼)
CH3COOH + H2O ←→ CH3COO- + H3O+(酸)
H3O+ + OH- ←→ 2H2O
——————————————————————————————————————————————
淨反應:CH3COOH+NH3 ←→ CH3COONH4
在液態二氧化硫中, SOCl2是酸,Cs2SO3是鹼:
2SO2 ←→ SO2+ + SO32-
SOCl2 ←→ SO2+ + 2Cl-
Cs2SO3 ←→ 2Cs+ + SO32-
——————————————————————————————————————————————
淨反應:SOCl2 + Cs2SO3 —→ 2CsCl + 2SO2
液態BrF3中SbF3與KF發生反應,BrF3按下式電離:
2BrF3 ←→ BrF2+ + BrF4- ①
SbF5和KF分別按下列式子與BrF3反應:
SbF5 + BrF3 → BrF2+ SbF6- ,SbF5為酸
KF + BrF3 → BrF4- + K+ ,KF為鹼
BrF2+ + BrF4- ←→ 2BrF3
——————————————————————————————————————————————
淨反應: KF+SbF5 → KSbF6
液氨中的酸鹼反應包括:
2NaNH2 (鹼) + Zn(NH2)2 (兩性) → Na2[Zn(NH2)4] 2NH4I (酸) + Zn(NH2)2 (兩性) → [Zn(NH3)4)]I2 硝酸在純硫酸中是鹼:
HNO3 (鹼) + 2H2SO4 → NO2+ + H3O+ + 2HSO4− 液態四氧化二氮中:
AgNO3 (鹼) + NOCl (酸) → N2O4 + AgCl
中和就是生成溶劑的反應,如在液態二氧化硫體系中: Cs2SO3+SOCl2─→2SO2+2CsCl
Cs2SO3和SOCl2滴定,就像在水溶液中酸鹼滴定生成水一樣。溶劑體系適用於能解離的溶劑。
在非質子溶劑中:
N2O4 ⇌ NO+ (亞硝基正離子) + NO3− (硝酸根) 2SbCl3 ⇌ SbCl2+ + SbCl4− 酸導致溶劑陽離子濃度上升,陰離子濃度下降;而鹼則導致陽離子濃度下降,陰離子濃度上升。
例如在液氨中,KNH2提供NH2−離子,是強鹼,而NH4NO3提供NH4+離子,是強酸。在液態二氧化硫(SO2)中,亞硫醯基化合物是酸,提供SO2+離子;而亞硫酸鹽提供SO32−離子,可看作鹼。
酸鹼溶劑理論中,同一化合物在不同溶劑中可以改變其酸鹼性質,比如HClO4在水中是強酸,在乙酸中是弱酸,而在氟磺酸中則是弱鹼。
優點
溶劑體系理論可把酸鹼概念擴展到完全不涉及質子的溶劑體系中。水-離子理論只是水作為溶劑時的溶劑體系理論的特例。質子理論可看作是對質系理論。
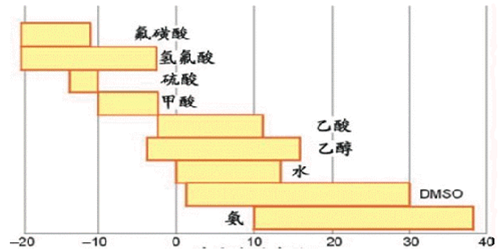
但是,溶劑體系理論只能適用於能發生自電離的溶劑體系中。實際上有不少的物質在烴類(如苯、氯仿、醚等)溶劑中也能表現出酸鹼行為。如發生中和反應、使指示劑變色、具有催化效應等,但這些溶劑幾乎不發生自電離作用。我們可以藉助路易斯酸鹼理論來說明。
