計算公式
液-液萃取常用於樣品中被測物質與基質的分離,在兩種不相容液體或相之間通過分配對樣品進行分離而達到被測物質純化和消除干擾物質的目的。在大部分情況下,一種液相是水溶劑,另一種液相是有機溶劑。可通過選擇兩種不相容的液體控制萃取過程的選擇性和分離效率。在水和有機相中,親水化合物的親水性越強,憎水性化合物將進入有機相中的程度就越大。通常,分析化學家首先在有機溶劑中分離出感興趣的被測物質,然後,由於常用的溶劑具有較高的蒸氣壓,可以通過蒸發的方法將溶劑除去,以便濃縮這些被測物質。
液-液萃取技術利用樣品中不同組分分配在兩種不混溶的溶劑中溶解度或分配比的不同來達到分離、提取或純化的目的。Nemat分配定律指出:物質將分配在兩種不混溶的液相中。如果以有機溶劑和水兩相為例,將含有有機物質的水溶液用有機溶劑萃取時,有機化合物就在這兩相間進行分配。在一定的溫度下有機物在兩種液相中的濃度比是一常數:
KD = CO/Cab
式中,KD是分配係數,co是有機相中物質的濃度,Cab是水相中此物質的濃度。有機物質在有機溶劑中的溶解度一般比在水相中的溶解度大,所以可以將它們從水溶液中萃取出來。分配係數越大,水相中的有機物可被有機溶劑萃取的效率會越高。但是,在許多的樣品體系中這些物質的分配係數差別較大,使用一次萃取是不可能將全部物質從水相中移入有機相中。
常規液液萃取
常規的液 液萃取方法使用分液漏斗,需要10-1000ml的液相(每一種)。對於一步萃取,為了獲得較大的回收率(在某一相中達99%以上),分配係數KD必須大於10,因為相比(Vo/Vaq)必須保持在0.1-10 之間。在大部分的分液漏斗的液 - 液萃取方法中,定量回收需要兩次或更多次的萃取。如下式:
E = 1-[1/(1+KDV)]n
式中,n 是萃取次數。如果某一種物質的分配係數KD=5,兩相的體積相等時(V=1),必須進行 3 次萃取(n=3)才能獲得大於889的回收率。每一次萃取都使用新鮮的溶劑。一般來說,多次萃取與一次萃取相比具有較高的萃取效率。
色譜分析中使用較多的是從水相中用與水不相溶的有機溶劑萃取有機物。通常使用的萃取器皿是分液漏斗。操作時應當選擇容積較液體樣品體積大1倍以上的分液漏斗,將分液漏斗的活塞擦乾,薄薄地塗上一層潤滑脂,塞好後再將活塞旋轉數圈,使潤滑脂均勻分布,然後放在萃取架上。關好活塞,將含有有機物的水樣品溶液和萃取溶劑依次自上口倒入分液漏斗中,塞好塞子。一般情況下,溶劑體積約為樣品溶液的30%-35%。為了增加兩相之間的接觸和提高萃取效率,應取下分液漏斗進行振盪。開始時搖晃要慢,每搖晃幾次之後就要將漏斗下口向上傾斜(朝向無人處),打開活塞,使過量的蒸氣逸出(也叫放氣)。然後將活塞關閉再進行振盪。如此重複直至放氣時只有很小的壓力,再劇烈地搖晃3-5min 後,將分液漏斗放回漏斗架上靜置。待漏斗中兩層液相完全分開後,打開上面的瓶塞,再將活塞慢慢地旋開,將下層液體自活塞放出。分液時一定要儘可能分離乾淨,有時在兩相間可能出現的一些絮狀物也立應時放出。然後將上層液體從分液漏斗的上口倒出,切不可也從活塞放出,以免被殘留在漏斗頸上的第一種液體所玷污。將水倒回分液漏斗中,再用新鮮的溶劑萃取。萃取次數取決於在兩相中的分配係數,一般為3-5 次。將所有的萃取液合併,加入合適的乾燥劑乾燥後即可用於色譜測定。如果濃縮倍數不夠,可將萃取液進行蒸發濃縮。
連續液液萃取
如果KD值小或者需要的樣品量大,多次萃取是不實際的。根據式(10-2-3)可能會需要很多的萃取次數,並且萃取的總體積也太大。在某些情況下,萃取的動力學可能是很慢的,需要很長時間才能建立平衡。在這些情況下,可以使用連續液 - 液萃取技術。
在連續液 - 液萃取中,新鮮的有機溶劑可以循環地連續使用,通過含有被萃取的水相。圖10-2-1表明一個連續液 - 液萃取器的結構,使用比水重的有機溶劑進行萃取。這種萃取溶劑從燒瓶中被加熱蒸餾,上升到冷凝器被冷凝,並淋漓出兩種不混合的水和帶有萃取物的溶劑。最後,溶劑和萃取物返回到燒瓶中。此過程連續地進行直到足夠量的被測物質被萃取出來。在某些模組中,燒瓶也作為濃縮器使用,連續萃取之後便於蒸發和除去萃取溶劑。
圖10-2-1 所示的裝置也可以使用比水輕的有機溶劑進行連續萃取。可以撤去溶劑返回管,由兩個塞子堵住接口,並將一端有玻璃篩板的漏斗管放進萃取器中,在萃取器中放入樣品和溶劑。冷凝的溶劑掉入漏斗並由於冷凝液的靜壓高差通過玻璃篩板。較輕的溶劑通過液體上升並且由於在萃取管中溢出而返回到燒瓶中。如果使用玻璃微珠充填萃取管內空間以減少萃取體積,給萃取溶劑提供彎曲的途徑以改進液 - 液接觸。
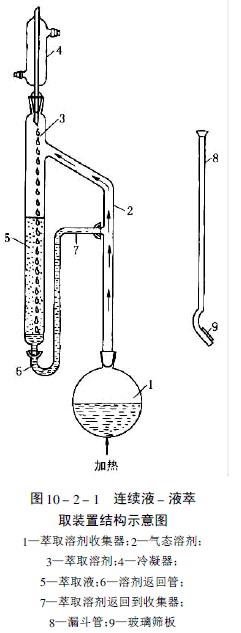
另一種連續萃取器在回流管中安裝有憎水膜,有商品的一步快速濃縮器(USA 產品)。膜將水隔離出濃縮器,因此,由於水引進的干擾被消除了,減少了整個萃取過程所需的時間,這樣通過蒸發也可以定量回收小於1ml的樣品。
與液 - 液萃取相比,連續液 - 液萃取具有如下優點:無需人工操作,可以處理低KD萃取,使用較少的溶劑,較高的效率。缺點是:在蒸餾過程中可能會損失高揮發性的化合物,熱不穩定化合物也可能會降解,除非他們能夠接受沸騰溶劑的溫度。如果膜安裝到系統中,可能會阻止廢水粒子,諸如泥巴等。
逆流萃取
逆流萃取(Countercurrent Distribution)裝置可以提供1000 或的者更多的塔板數用於更有效的液 - 液萃取,但是它需要很長時間和工作量。逆流萃取可以回收分配係數KD值相當小的組分。
從原理上講,可以在一系列的分液漏斗中進行逆流萃取,每一個漏斗含有一個指定的較低的相。樣品被引進到分液漏斗中上層液相併且在含有被測物質的上層液相平衡以後轉換到第二漏斗中。然後,引入新的上層溶劑相到第一漏斗中。重複這個平衡過程許多次。隨著自動逆流萃取裝置出現,此過程會進行數百次傳遞。逆流萃取過程非常類似於低分辨柱色譜,通過幾個萃取管分布著樣品的組分。對於難度大的樣品,逆流萃取過程是最有用的大範圍分離製備技術。
逆流色譜與逆流萃取緊密相關,逆流色譜是液 - 液分布技術,其中離心力和重力保持著固定相。
據調查,一種較新的逆流技術叫做離心萃取色譜,從水樣品中萃取欲測物質。在離心萃取色譜中,一系列的盤分立和相互無關的分配通道中的離心力保持著液體固定相。流動相以微小的液珠形式連續地通過固定相。樣品組分在流動相和固定相之間進行分配,並且依據它們的分配係數被分離。一個已知體積的樣品已經通過離心萃取色譜柱以後,流動方向變成反向並且新鮮的萃取溶劑被引進柱中將液體固定相中的被測物質淋洗出來。此技術已經被用於提純許多種化合物,包括廢水中的生物鹼、脂肪酸、抗生素(amtiboitics)和表面活性劑,廢棄(spiked)試劑和廢水中的酚、有機氯殺蟲劑。已有的研究中,與傳統的液1 液萃取相比,此項技術具有重要改進,諸如測定酚的溶劑用量少、濃縮倍數高、回收率好。但是,有機氯殺蟲劑的回收率差異較大。
微萃取
微萃取是另一種形式的液 - 液萃取技術,採用0.001-0.01範圍的相比率值(V)進行萃取過程。與傳統的液 - 液萃取相比,它採用小體積有機溶劑。微萃取提供的回收率較差,但是在有機相中的欲測物質的濃縮大大地增高。此外,使用的溶劑量也大大地減少。在容量瓶中進行萃取,可以選擇比水密度低的有機溶劑,結果有機溶劑積累在瓶頸部分並且便於抽取它們。在有機相中的被測物質的濃縮可以通過鹽析作用得到加強。可以採用樣品加入內標和萃取校正標準的方法進行測定。
萃取小柱技術
(Cartridges)
使用萃取夾代替分液漏斗完成液 - 液萃取,將一種液相混合到一種惰性介質中並經過一會兒地滲濾,與色譜相類似的方式,不相容相進入不流動相。這些萃取小柱同固相萃取小柱一樣,在聚乙烯管中填充經煅燒助溶的高純硅藻土。這些管的體積從0.3-300ml( 有商品出售)。具有大表面的填充物可提高萃取效率、防止水溶液樣品(被硅藻土吸附的)和有機萃取溶劑之間的乳化。此技術操作簡單,可以用於含有誤用藥物的體液的萃取。可先使用樣品潤濕萃取小柱中的吸附劑幾分鐘後,再將有機萃取溶劑加入到萃取小柱中。當有機溶劑還保存在萃取
小柱中時(已經含有萃取物質),分別調節pH值在4.5 和9.0 時,以萃取樣品中的酸性或鹼性物質
線上萃取
動態線上液 - 液萃取系統是採用流動注射分析的原理。流動注射分析與液相色譜基本一樣,只是它使用開口窄孔管(萃取環),而液相色譜使用填充柱。 在最簡單的液 - 液萃取" 流動注射分析(如圖10-2-2)中,欲測物質連續地被引入含有活性的或者絡合試劑水相中,或者有機樣品溶液連續地或間歇性地被引入含有活性的或者絡合試劑水相中。化學反應或者絡合作用在混合反應環中發生並生成可萃取的組分。然後,含有萃取組分的多水蒸氣在相沉澱器中套用有機不相容的溶劑被沉澱,在那兒,以另一種形式形成小的可再生成的液珠。由於沉澱的溶劑部分通過萃取環運動,有機或多水溶劑弄濕了內壁,根據萃取環的彎管類型,產生了一個薄膜並由此作為一個界面,進行欲測物質的分配過程。過
程的萃取效率是萃取環中保持時間、沉澱量、環直徑尺寸和結構材料的函式。在萃取環的終端,水或有機溶劑在相沉澱器中被不斷地分離。
含有被測物質的部分常常使用流過監測器測量,不想要的部分被直接地排除掉。也有學者研究了更複雜的線上萃取系統,套用膜分離器件、吸收水的微柱分離器、預濃縮裝置等濃縮欲測定物質。
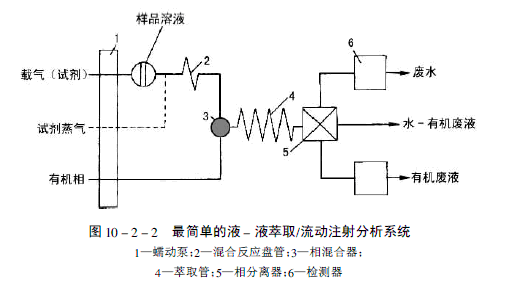
線上萃取系統的優點是,可用於非常小的樣品體積(低於100ml),使用小量的試劑和有機溶劑(費用降低),閉環系統(樣品不會暴露到大氣中,防止了污染和對人的毒性及溶劑的可燃性),高的樣品萃取產率,可充分自動化,流動系統的接口可直接與分析儀器相連線。缺點是,與批萃取(使用預濃縮技術除外)濃縮技術相比,靈敏度較低,要求更複雜的硬體(泵、相沉澱器、相分離器)。通常,人們不願接受常規樣品製備中的流動萃取系統。
自動液液萃取
傳統的液 - 液萃取需要大量的手工操作,當樣品負荷增加,並超過了合理的程度,人們就會考慮自動化。許多儀器廠家研製了全部自動或者部分自動地完成樣品萃取和濃縮的裝置。某些氣相色譜或者高壓液相色譜的自動進樣器和工作站可以完成自動液! 液萃取過程。
這種自動系統大多套用於液體易於分散和混合的體系,在小樣品瓶中進行液 - 液萃取。某些自動化系統通過自動進樣器針頭交替地抽取和注入溶劑和樣品的方法在小樣品瓶中進行液 - 液萃取。也有這樣的裝置,使用渦流混合的方法使樣品瓶高速旋轉,完成液 - 液萃取。然後靜置樣品瓶,直等到樣品瓶中液體分層分離時,通過控制自動進樣器的針頭長度,或者抽取上層或者下層液體進行儀器分析測定。此種方法通常處理小體積的樣品(ml 水平),對於大體積樣品的液 - 液萃取處理還需要進行改進,諸如1L 水樣品(美國EPA 要求的方法)的液 - 液萃取。
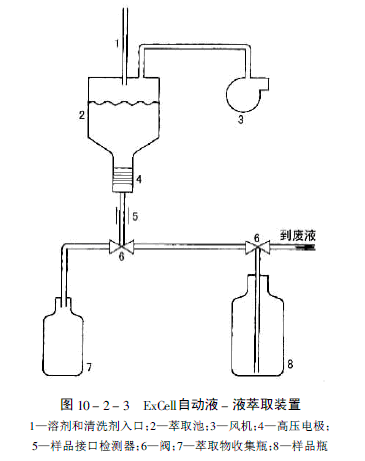
美國OI分析公司根據EPA - SW 846 方法3510-3520,研製了ExCell自動液 - 液萃取系統。此系統使用二氯甲烷作為萃取劑,在約+9 時間內可同時處理 6 個1L水樣品中半揮發性物質的液 - 液萃取。此系統的萃取過程與傳統的分液漏斗的液 - 液萃取不同,如圖10-2-3所示。在萃取池中裝有二氯甲烷溶劑,溶劑液體表面上通過風機作用使萃取池形成輕微的真空,水樣品以液滴方式連續地被引進到萃取溶劑中。水樣品液滴在進入二氯甲烷溶劑過程中,先通過一個專用的由外部電極產生的電場區域。電場促使萃取溶劑中的水滴進行運動,液滴形
狀產生扭曲並分裂成更小的液滴。這種分裂在水相和二氯甲烷相之間的界面上大量增加,導致水滴中的欲測定有機物分子快速地擴散進入二氯甲烷中。
在萃取之後,這個電場的另一個區域是促使碎裂的液滴融合併重新聚集,因為萃取過程具有這一特性,所以不會發生乳化。此裝置還可以處理像淤泥和塵粒這樣的多水樣品。
所有的水樣品通過電場之後,樣品被分成兩層。二氯甲烷萃取液可以被自動地輸送到收集器中用於蒸發濃縮或者再進一步地樣品製備。如果必要的話,一個任選的線上乾燥裝置可用於除去萃取液中殘存的水。萃取完成時,萃取池可自動地使用溶液清洗四次。ExCell系統可使用 3 個串聯的80ml 萃取器同時回收目標化合物。在配製的6個含50mg/L濃度酚和多環芳烴的水溶液標準樣品中,此系統提供萃取回收率等同於可接受的連續液 - 液萃取方法,平均標準偏差為2%-5%。
破乳常用方法
液 - 液萃取中非常重要的操作是急速地振動樣品。此步驟可確保兩相的完全接觸,有助於質量傳遞。在分液漏斗發生完全的混合,產生大量的界面區域使得有效的分配出現。由於物質劇烈的振動,在液 - 液萃取中乳化現象經常發生,特別是那些含有表面活性劑和脂肪的樣品。收集欲測物質必須先進行破乳。為了防止乳化形成,套用採取加熱或加鹽的方法破乳。通過改變KD,改變溶劑或化學平衡作用的添加劑,諸如使用緩衝劑調節pH,鹽調節離子強度等。用於破乳的常用技術如下:
①加鹽;
②使用加熱 - 冷卻萃取容器;
③通過玻璃棉塞過濾乳化液樣品;
④通過相過濾紙過濾乳化液樣品;
⑤通過離心作用;
六加進少量的不同的有機溶劑。
在液 - 液萃取過程中,有機相、水相、乳化物和外力是乳化形成的主要因素,如果破壞乳化形成的條件就可以防止和避免乳化的形成。諸如,在臟器、血液等生物樣品的萃取前,在研缽中先加入等量的無水硫酸鈉與樣品同時研磨,直至乾沙狀後,經有機溶劑萃取就不會發生乳化現象,而且可獲得較高的萃取效率。但本法不適用溶液萃取。在水溶液樣品中加入氯化鈉使之飽和,再用有機溶劑萃取可有效地防止因為有機相與水相比重接近易引起的乳化現象。在生物體試樣中含有蛋白、油脂等乳化物,它們具有降低有機相和水相界面張力的功能,將有機相液珠與水相粘合在一起,形成相對穩定的乳狀液。如果除去這些乳化物就能避免乳化的形成。除去乳化物的方法很多,應當根據萃取的目的決定。例如,在萃取生物試樣中不揮發性有機物時,常用的方法有:酸性乙醇浸取法、三氯乙酸沉澱蛋白法、冷凍除油脂法等等均可除掉樣品中的蛋白、脂肪等乳化物。此外,提高兩相的體積比,一般地保持兩相體積比為1:(5-10)時,可有效地防止乳化。在劇烈振搖時發生乳化,採用緩慢振搖可防止乳化。
在液 - 液萃取過程中發生乳化現象時,可根據乳化的程度採用適當的方法消除乳化。
如果樣品出現高度乳化(即全部乳化),可採用離心法破乳。破乳率隨離心轉數的增加而增大,也隨作用時間的延長而增大。通常採用2000r/min,作用2minj 後的破乳率可達100%。但離心法不適用微乳液的破乳。也可以採用無水硫酸鈉研磨法破乳,將乳濁液轉入研缽中,使用無水硫酸鈉研磨至沙狀後再進行萃取可消除乳化現象。還可以採用蒸乾法,將乳濁液置入蒸發皿中,於100℃沸水浴蒸乾後,再用有機溶劑萃取。但本法不適用揮發性物質的萃取。
如果樣品出現中度乳化(乳化率達50%),可加入電解質破乳。諸如,如果是屬於兩相比重引起的乳化,加入可溶解性無機鹽(例如氯化鈉)於水相中,通過提高體系中水相的比重使兩相分層;如果仍然不能分層,可加入1mol/L的鹽酸消除乳化。如果屬於兩相比重相差較大形成的乳化,加入無水乙醇能溶解相互粘合的兩相液滴,破乳的效果也比較好。通常,破乳率與加入電解質的量成正比。此外,將乳濁液經過無水硫酸鈉漏斗過濾也可以完全地消除中度乳化。
如果樣品出現輕度乳化(兩相間形成一薄乳化層),可使用玻璃棒攪動乳化層,削弱乳化物分子的吸附作用;或者使用細金屬絲與容器壁摩擦,破壞膠體粒子的雙電層。這種方法能消除輕度乳化,既簡單又避免了雜質的引入。由於乳濁液是液體雜質以微小珠滴散布在液體溶劑中的一種分散體系,是熱力學不穩定體系,如果將其靜置一定的時間後,可自然分層。此種方法比較費時間,但是不會引入雜質。




