質量要求,注射用無菌分裝製品,製備工藝流程,製備工藝,無菌分裝產品可能存在的問題及處理方法,注射用冷凍乾燥製品,冷凍乾燥技術的原理與特點,製備流程與工藝,冷凍乾燥中存在的問題及處理方法,舉例,
質量要求
除應符合《中國藥典》(2015年版)對注射用原料藥物的各項規定外,還應符合下列要求:粉末無異物,配成溶液後可見異物檢查合格;粉末細度或晶度應適應,便於分裝;無菌、無熱源。
多數情況下,由於製成分針的藥物穩定性較差,沒有滅菌過程而是採用無菌工藝,因此,對無菌操作有嚴格的要求,特別是再除菌、灌封等關鍵工序上,必須採用層流潔淨措施,以保證操作環境的潔淨度。
注射用無菌分裝製品
注射用無菌分裝製品系指將採用滅菌溶劑結晶法、噴霧乾燥法製得的無菌原料藥,在無菌條件下直接分裝於潔淨滅菌的小瓶或安瓿中,密封而製備。常用於抗生素藥物,如注射用青黴素鈉、注射用頭孢呋辛鈉等。
製備工藝流程
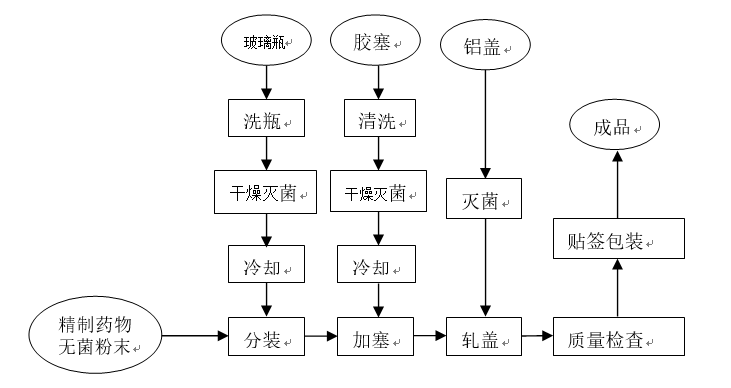
注射用無菌分裝製品的製備工藝流程如圖
製備工藝
1.原材料及容器的準備
在無菌條件下採用結晶法或噴霧乾燥法製備無菌原料,必要時在無菌條件下進行粉碎、過篩等操作,製得晶型、粒度、密度符合分裝要求的注射用無菌粉末。
安瓿、玻璃瓶、膠塞按注射液要求進行洗滌,並需進行滅菌處理。安瓿或玻璃瓶可於180℃乾熱滅菌1.5小時或於250℃乾熱滅菌45分鐘,膠寨洗淨後要用矽油進行處理,再用125℃乾熱滅菌2.5小時或於121℃濕熱滅菌30分鐘,滅菌好的空瓶應在淨化空氣下存放,時間一般不應超過24小時,具體存放時間應經驗證後確定。
2.無菌粉末的分裝和封口
分裝必須在潔淨環境中按無菌操作法進行,一般最終滅菌工藝產品的生產操作為C級背景下的局部A級,非最終滅菌產品的無菌生產操作為B級背景下的A級。分裝時多以容積進行定量,可用人工法或機械分裝法。手工分裝常採用刮板式分裝器,機械分裝設備有螺旋式自動分裝機、直管式自動分裝機和真空吸粉自動分裝機等,分裝機宜有局部層流裝置。分裝好的小瓶應立即加塞並用鋁蓋密封。為了避免鋁屑污染產品,軋蓋常與分裝分開在另一台設備上完成。若是安瓿,分裝後應立即用火焰熔封。
3.滅菌和異物檢查
對於耐熱品種,可選用適宜的滅菌方法進行補充滅菌,以確保無菌水平。對於不耐熱的品種,必須嚴格執行無菌操作,產品不再滅菌。異物檢查一般在傳送帶上用目檢視,剔除異物不符合規定的產品。
4.印字包裝
檢驗合格的產品進入印字工序,目前生產均已實現機械化、自動化。
無菌分裝產品可能存在的問題及處理方法
1.裝量差異
無菌分裝製品的裝量差異不符合要求的主要原因是待分裝無菌物料的流動性較差。物料的吸潮性、含水量和藥物的結晶形態、粒度、比容以及機械設備性能等均會影響物料的流動性,從而影響裝量差異,應根據具體情況分別採取相應的措施。對於物料吸濕、含水量大引起的流動性下降,應採取控制環境濕度使其低於物料的臨界相對濕度;對於藥物不適宜的物理性質引起的流動性下降,應通過適宜的措施如粉碎、噴霧乾燥等操作改變物料的結晶形態、粒度、比容等物理性質,使其易於流動,降低裝置差異。
2.可見異物和不溶性微粒
由於無菌分裝藥物粉末未經過配液、過濾等一系列的處理,污染機率增加,以致無菌粉末溶解後檢查可見異物、不溶性微粒不符合注射劑的要求。因此,應從原料質量開始嚴格控制無菌分裝製品的全生產過程,防止污染。
3.染菌
由於無菌分裝製品是通過無菌操作製備的,所以生產過程中受到污染的機會增大,而且微生物在固體粉末中繁殖慢,不易被肉眼觀察,危險性更大。因此,需要嚴格控制無菌環境和無菌操作,在經過定期檢測的A級淨化條件下分裝。
4.吸潮變質
藥物粉末吸潮,除會導致無菌分裝製品的裝量變異增大外,還有可能引起藥物的分解變質。吸潮一般認為是由於密封膠塞透氣和鋁蓋鬆動所致,故需進行橡膠塞密封檢測,鋁蓋壓緊後,必要時採用蠟封確保封口嚴密。另外還可以採取控制無菌分裝室的相對濕度低於藥物的臨界相對濕度,以避免藥物粉末吸濕。
注射用冷凍乾燥製品
注射用冷凍乾燥製品系將藥物配製成無菌水溶液或均勻的混懸液,分裝於容器中,經冷凍乾燥法除去水分,密封后得到的無菌注射粉末。凡對熱敏感或在水中不穩定的藥物均適用於製成冷凍乾燥製品,如蛋白質、酶等生物製品(注射用重組人干擾素α2b、注射用輔酶A)等。有冷凍乾燥法製備的生物製品注射用無菌粉末,也可稱為注射用凍乾製劑。
冷凍乾燥技術的原理與特點
1.冷凍乾燥的原理
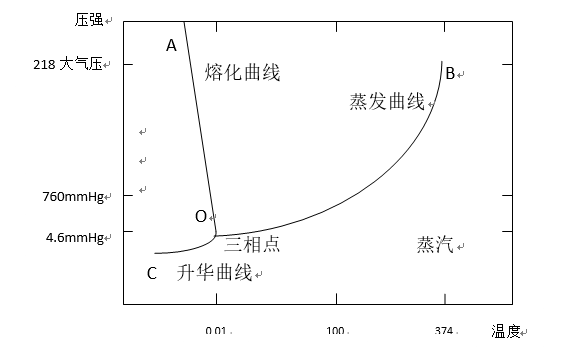
冷凍乾燥的原理可以用水的三相圖說明。圖中OA線是冰和水的平衡曲線:OB線是水和水蒸氣的平衡曲線;0C線是冰和水蒸氣的平衡曲線,在此線上冰、氣共存;O點是冰、水、氣的平衡點,在此溫度和壓力時(即溫度0.01℃,壓力4.6mmHg),冰、水、氣共存。由此圖可見當壓力低於4.6mmHg時,無論溫度如何變化,水只能以固態和氣態存在。即說明固態(冰)受熱時可不經過液態(水)直接轉變為氣態;而氣態遇冷時放熱直接轉變為固體冰。根據平衡曲線OC,對於固體冰,升高溫度或降低壓力都可打破氣-固平衡,使整個系統朝著冰轉變為氣的方向進行,最終完成乾燥,冷凍乾燥就是根據這個原理進行的。
2.冷凍乾燥的特點
冷凍乾燥因在低溫、真空下乾燥,具有以下突出的優點:①避免藥物因高溫乾燥而分解,適用於熱敏性藥物;②冷凍乾燥製品質地疏鬆多孔,加水後迅速溶解,恢復藥液的原有特性;③乾燥在真空下進行,藥物不易氧化,還可減少微粒的污染;④含水量低,能除去95%~99%以上的水分;⑤產品劑量準確,外觀優良。
缺點:冷凍乾燥對溶劑的選擇範圍很窄,生產設備要求較高,乾燥時間長,生產能耗大等。凍乾粉針的製備過程中通常採用過濾除菌,不如注射液高溫滅菌效果可靠。
製備流程與工藝
1.工藝流程
冷凍乾燥製品製備工藝包括先將藥物配製成溶液,過濾、分裝、在低溫下凍結,然後在真空條件下加熱升華乾燥,除去冰晶,待升華結束後,再進行解吸乾燥,除去部分結合水、密封等過程。
2.製備工藝
注射用冷凍乾燥製品在凍乾之前的操作與溶液型注射劑基本相同,需經過配液、過濾、分裝,只是分裝時注意溶液不能太厚,一般不宜超過10-15mm,以利於水分的蒸發。分裝好藥液的西林瓶(開口)送入冷凍乾燥機的乾燥箱中,進行預凍、升華、乾燥,最後封口即可。本品屬於非終端滅菌產品,應注意灌裝、冷凍乾燥、壓蓋等暴露工序的潔淨環境應為B級背景下的局部A級。
冷凍乾燥中存在的問題及處理方法
1.含水量偏高
藥液裝入過厚、升華乾燥過程中供熱不足、冷凝器的溫度偏高成真空度不夠均可能導致含水量偏高,可採用旋轉冷凍機及其他相應的措施解決。
2.產品外形不飽滿或萎縮
一些黏稠的藥液由於結構過於緻密,在凍乾過程中內部的水蒸氣逸出不完全,凍乾結束後,製品因潮解而萎縮。可在處方中加入適量甘露醇、氯化鈉等填充劑,並採取反覆預凍升華法,以改善製品的通氣性,改善產品的外觀。
3.噴瓶
凍乾過程中如預凍不完全或供熱太快,受熱不勻,使製品部分液化,則易在升華過程中的真空減壓條件下產生噴瓶。為防止噴瓶,必須控制預凍溫度在低共熔點以下10-20℃,同時加熱升華時溫度不宜超過低共熔點。
舉例
例:注射用法莫替丁
【處方】法莫替丁20g,甘露醇10g,L-門冬氨酸8g,注射用水1000ml。
【製備】取注射用水500ml,依次加人法莫替丁及L-門冬氨酸,加熱50℃,攪拌約30分鐘至全溶,加甘露醇,攪拌溶解,加入溶液量0.1%的活性炭,保溫攪拌15分鐘,過濾除炭,補加注射用水至全量,以0.22µm微孔濾膜過濾,灌裝,每支1ml,冷凍乾燥,真空壓塞,軋蓋,半成品質量檢查合格後,印字包裝。
【註解】①法莫替丁顯弱鹼性,在水中不溶,但可與門冬氨酸形成易溶於水的鹽。因此,處方中採取兩者等摩爾比加入成鹽,增大溶解度。升高濕度有利於成鹽反應的進行。L-門冬氨酸為二元酸,只有一個酸根參與法莫替丁的成鹽。②法莫替丁與L-門冬氨酸形成的鹽,只有在冷凍凍乾時形成無定形固體而迅速溶於水。