永停滴定法(dead-stop titration)又稱為雙電流或雙安培滴定法。它是根據滴定過程中電流的變化確定滴定終點的方法。它操作簡單,確定終點方便快捷。
基本介紹
- 中文名:永停滴定法
- 外文名:Dead-stop Titration
- 別名:雙安培滴定法
- 歸類:電化學分析法
定義
測量方法
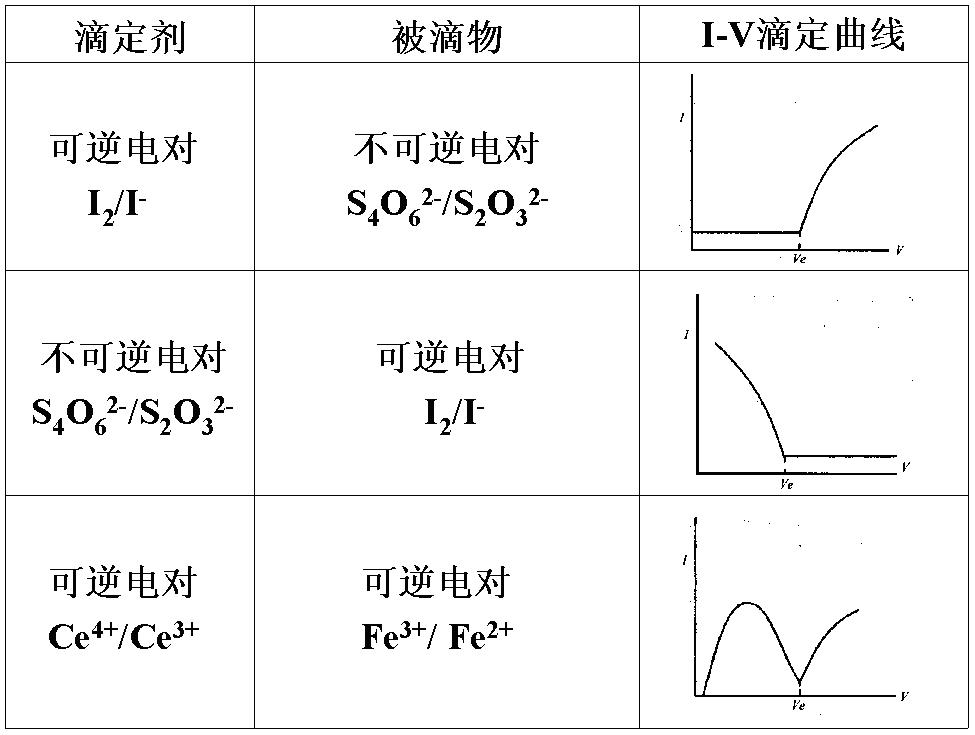
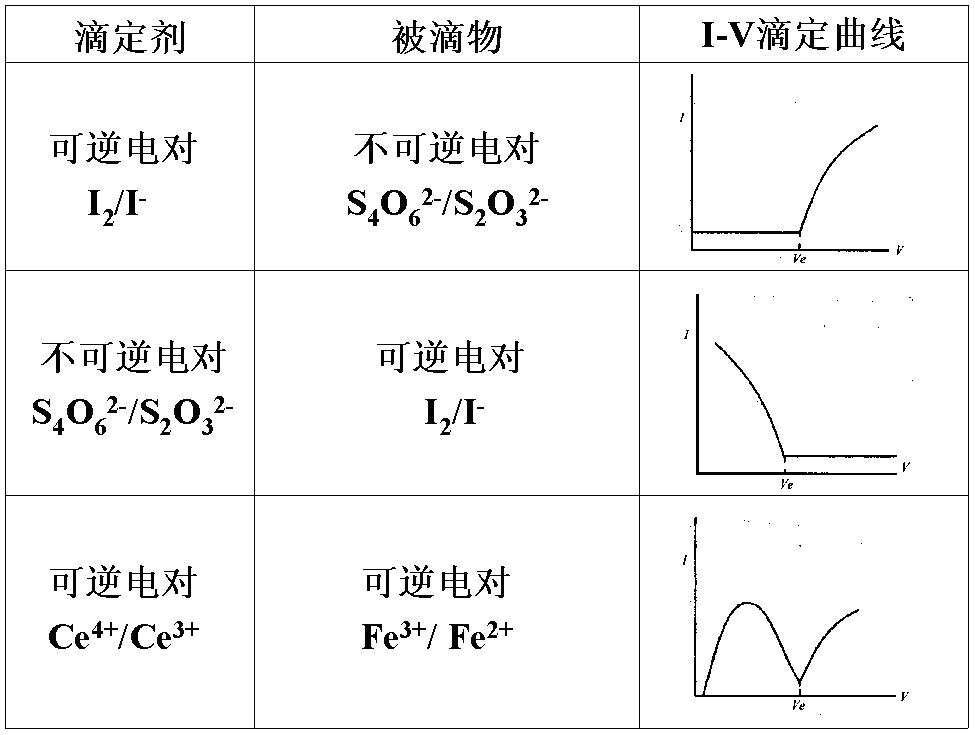
曲線判斷



























永停滴定法(dead-stop titration)又稱為雙電流或雙安培滴定法。它是根據滴定過程中電流的變化確定滴定終點的方法。它操作簡單,確定終點方便快捷。




























永停滴定法(dead-stop titration)又稱為雙電流或雙安培滴定法。它是根據滴定過程中電流的變化確定滴定終點的方法。它操作簡單,確定終點方便快捷。...
安培滴定法亦稱電流滴定法,是在電解池中根據溶液的電流變動來指示滴定終點的電極滴定化學分析方法,其中又可以分為一個極化電極和兩個極化電極。把滴汞電極當作極化...
雙安培滴定法(doubleamperometrictitration),又稱永停滴定法(dead-stoptitration)或雙電流滴定法,是根據滴定過程中電流的變化確定滴定終點的方法,屬於電流滴定法。...
滴定時將滴定管尖端插入液面下約2/3處,隨滴隨攪拌;至近終點時,將滴定管尖端提出液面,用少量水洗滌尖端,洗液併入溶液中,繼續緩緩滴定,用永停滴定法(附錄ⅧA)...
永停滴定法是根據滴定過程中雙鉑電極電流的變化來確定化學計量點的電流滴定法,又稱雙電流或雙安培滴定法。永停滴定法就是依據在外加小電壓下,溶液中有可逆電對...
亞硝酸鈉滴定法(Sodium nitrite method)是利用亞硝酸鈉滴定液在鹽酸溶液中與有機氨類化合物發生重氮化反應或者亞硝基化反應進行的氧化還原滴定法。...
方法名稱: Benzocaine原料藥—Benzocaine的測定—永停滴定法 套用範圍: 本方法採用滴定法測定Benzocaine原料藥中Benzocaine的含量。 本方法適用於Benzocaine原料藥。 方法...
該方法適用於磺胺甲惡唑。方法原理:供試品用鹽酸溶液溶解,按照永停滴定法,用亞硝酸鈉滴定液滴定,計算磺胺甲惡唑含量。試劑:1.水2. 鹽酸溶液(1→2)...
本方法適用於異卡波肼原料藥。方法原理: 供試品照永停滴定法用亞硝酸鈉滴定液滴定,根據滴定液使用量,計算異卡波肼的含量。試劑: 1. 濃氨試液...
醋氨苯碸—醋氨苯碸的測定—永停滴定法套用範圍:該方法採用永停滴定法測定醋氨苯碸(C16H16N2 O4 S)的含量。該方法適用於醋氨苯碸的含量測定。...
方法名稱: 鹽酸普魯卡因胺的測定—永停滴定法套用範圍: 本方法採用滴定法測定鹽酸普魯卡因胺的含量。本方法適用於鹽酸普魯卡因胺。方法原理: 供試品照永停滴定法,用...
套用範圍: 本方法採用永停滴定法測定硫酸雙肼屈嗪(C8H10N6·H2SO4)的含量。本方法適用於硫酸雙肼屈嗪的含量測定。方法原理: 供試品加水與鹽酸溶液溶解後,放...
方法名稱: 氨苯碸的測定—永停滴定法套用範圍: 本方法採用滴定法測定氨苯碸的含量。本方法適用於氨苯碸。方法原理: 供試品加水和鹽酸溶液後,照永停滴定法,用...
方法名稱: 甲氧氯普胺原料藥—甲氧氯普胺的測定—永停滴定法 甲氧氯普胺 套用範圍: 本方法採用滴定法測定甲氧氯普胺原料藥中甲氧氯普胺的含量。...
另外有觀察滴定過程中電流變化以確定等當點的永停滴定法,還有電導滴定、高頻滴定等。這些方法的套用使一些用指示劑難以判斷終點的滴定得以進行,並可以提高滴定分析...
(1→2)40ml,分數次洗滌,每次5ml,合併濾液與洗液,加溴化鉀3g溶解後,照永停滴定法(附錄53頁),同亞硝酸鈉液(0.1mol/L)滴定,但電流計的靈敏度改用10<-3>/...
內容涉及誤差與分析數據處理、重量分析法、酸鹼滴定法、沉澱滴定法、配位滴定法、氧化還原滴定法、電位法和永停滴定法、紫外-可見分光光度法、螢光分析法、原子吸收...
