一種與中和作用相反的作用。即礦物中加入水引起分解的化學變化過程。例如Na2CO3+H2O→2Na++ HC03 - +OH -,也就是一種離子和水的離子相結合的作用。自然界中長石水解時,水分子中的H+置換長石中的鹼及鹼土元素離子,H+進入結晶格架內而形成粘土類礦物。
基本介紹
- 中文名:水解作用
- 外文名:hydrolysis
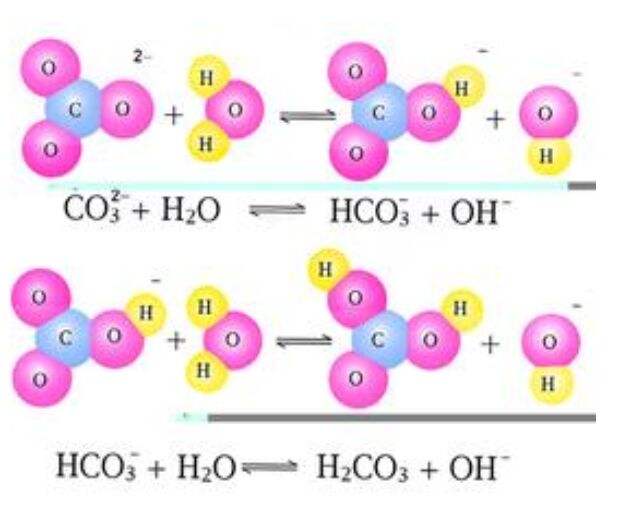
一種與中和作用相反的作用。即礦物中加入水引起分解的化學變化過程。例如Na2CO3+H2O→2Na++ HC03 - +OH -,也就是一種離子和水的離子相結合的作用。自然界中長石水解時,水分子中的H+置換長石中的鹼及鹼土元素離子,H+進入結晶格架內而形成粘土類礦物。
一種與中和作用相反的作用。即礦物中加入水引起分解的化學變化過程。例如Na2CO3+H2O→2Na++ HC03 - +OH -,也就是一種離子和水的離子相結合的作用。自然界...
水有分解和融合材料的雙重特性,水解是一種分解技術。水解是一種化工單元過程,是利用水將物質分解形成新的物質的過程。水解是鹽電離出的離子結合了水電離出的氫離子...
水解反應中有機化學概念是水與另一化合物反應,該化合物分解為兩部分,水中的H+加到其中的一部分,而羥基(-OH)加到另一部分,因而得到兩種或兩種以上新的化合物的...
蛋白質水解是指蛋白質在水解酶(protease,proteinase)的催化作用下水解過程的統稱。這一過程所形成的水解產物在人體內要比自由胺基酸和沒有水解的蛋白質更易於吸收。....
蛋白水解作用pr}tealysi,指其分子中的吠鍵逐步斷裂而產生較短的膚段或游離的胺基酸的過程按蛋自質水解程度的不同,可分為完辛水解和不完全水解。...
水解作用是指水離解出的OH 離子與礦物離解出的陽離子,如Na+,K+等,結合形成帶OH新礦物的過程。碳酸化作用是指當CO,溶解於水中時,形成CO3- 和HCO3 離子,...
水解蛋白是用乳酪素或血纖維經酸解或酶解所製得,為淡黃色或近灰黃色塊狀或粒狀物;易潮解,有特殊臭,但不應有腐敗臭。能溶於水。含氨基氮應為總氮(N)的50%...
在溶液中鹽的離子跟水所電離出來的H+或OH-生成弱電解質的過程叫做鹽類的水解。並使水的電離平衡向正方向移動,從而促進水的的電離。鹽類的水解所需條件:鹽必須溶...
水解蛋白就是經過水解工藝加工的蛋白,把完整的大分子蛋白進行切割,變成小分子的蛋白甚至游離的胺基酸。採用水解蛋白作為蛋白質來源的奶粉稱為水解蛋白奶粉。根據水解...
水解處理方法是一種介於好氧和厭氧處理法之間的方法,和其它工藝組合可以降低處理成本提高處理效率。水解是指有機物進入微生物細胞前、在胞外進行的生物化學反應。...
3 保健作用 水解膠原蛋白肽選擇標準 編輯 標準一 膠原蛋白的分子量越小越好人體在吸收膠原蛋白時,分子量是非常關鍵的因素,分子量越小越易被人體吸收。膠原蛋白的分...
鹽類在溶液中,與水作用而改變溶液的酸鹼性的反應叫作鹽類的水解。水解常數的大小表示鹽的水解達到平衡時,水解程度的大小,水解常數的大小取決於鹽中弱酸或弱鹼的解離...
蛋白水解(英語:Proteolysis)是指蛋白質降解為較小的多肽或胺基酸的過程。通常情況下,被水解的都是肽鍵,且在蛋白酶的作用下進行,因此常用蛋白酶解。...
鹽的水解反應:凡是組成鹽的離子與水作用產生弱酸或弱鹼,並改變溶液酸度的反應都叫做鹽的水解反應 弱鹼陽離子水解使溶液顯酸性(氯化銨) 強鹼陽離子,強酸酸根離子不...
用於確定分枝桿菌屬( Mycobacterium)一定的菌株能否在5天或tU夭內水解吐溫80的試驗。堪薩斯分枝桿菌(M. ka}csii)和草分枝桿菌(} per)等產生陽性反應。 ...
水解膠原 外文名 hydrolyzed collagen 用於 中性乳飲料、酸性乳飲料 作用 可增強奶粉的功能性 適應人群 工作勞累,睡眠不足 美容作用 眼霜成分 膠原...
細菌水解產物生產飼料或飼料組分,例如可口性提高製劑的方法,所述方法包含用酶法水解作用來處理包含甲烷營養型細菌的微生物培養物。 ...
水解單寧是由棓酸,或是棓酸衍生的酚羧酸與多元醇組成的酯在酸、鹼和酶的作用下產生的多元醇和酚羧酸。...
生物中常有一分子澱粉水解為2分子葡萄糖。...... 一分子澱粉水解為2分子葡萄糖 用途 水解生成麥芽糖 澱粉為高分子化合物[1] ,一定條件下可以水解方程式:(C6H10...
