理化特性
物理性質
外觀與性狀:黑褐色粉末
化學性質
還原反應
還原反應為氧化銅還原成銅的過程
原理:氧化銅(灼熱)可以和氫氣(H
2)、碳(C)、一氧化碳(CO)等具有
還原性物質反應,生成銅+X(氧化物)。
一、碳還原用品:試管、單孔塞、酒精燈、鐵架台、木炭、氧化銅、石灰水。
操作方法及原理:把經過烘乾的木炭粉末和氧化銅粉末混合均勻,小心地鋪放進試管,並將試管固定在
碳還原氧化銅鐵架台上。試管口裝有通入
澄清石灰水的導管(如圖所示),用酒精燈(可加網罩以使火焰集中並提高溫度)加熱混合物幾分鐘。然後先撤出導氣管,待試管冷卻後再把試管里的粉末倒在紙上。觀察現象並分析。在這個反應里,氧化銅失去氧而變成單質銅。這種含氧化合物里的氧被奪去的反應,叫做
還原反應。其中碳是還原劑。木炭是使氧化銅還原為銅的物質,它具有
還原性。單質碳的還原性可用於冶金工業。
現象:黑色粉末逐漸變成光亮的紅色,生成氣體通入澄清的
石灰水後,使
澄清石灰水變渾濁,若持續通入,變渾濁的石灰水又會變清。
化學方程式:2CuO+C=2Cu+CO
2↑(高溫)
二、一氧化碳還原用品:鐵架台、酒精燈、試管、導管、一氧化碳氣體
操作方法:①先通入CO一會兒 ②加熱 ③停止加熱 ④繼續通入CO到玻璃管冷卻為止
註:①先通入CO一會兒,是為了防止玻璃管內的空氣沒有排盡加熱時發生爆炸. ②繼續通入CO到玻璃管冷卻為止,是為了防止生成的銅重新被氧化為氧化銅. 總之:“CO早出晚歸酒精燈遲到早退”,也說“先通後點防爆炸,先熄後停防氧化。” ③用酒精燈點燃是進行尾氣處理:防止一氧化碳污染空氣 ④此試驗 應在通風櫥中進行:防止沒除淨的CO使人中毒
現象:①黑色固體變成紅色 ②
澄清石灰水變渾濁
化學方程式:CuO+CO=Cu+CO
2(加熱/△)
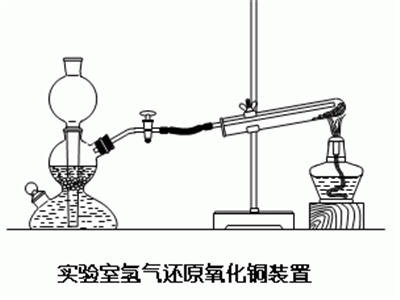 實驗製法
實驗製法 三、氫氣還原實驗用品錐形瓶、粗銅絲、酒精燈、啟普發生器、鋅粒、
稀硫酸(1:4)。
實驗步驟:
( 1) 在鐵架台的立柱上,把粗銅絲繞成如圖28所示的螺旋形,置於酒精燈外焰上,高溫加熱呈紅熱狀態,使銅絲的螺旋部位有足夠量的黑色氧化銅生成。
(2) 用錐形瓶(或集氣瓶)集滿一瓶氫氣。把赤熱的銅絲從酒精火焰上取出稍冷,讓學生觀察銅絲外表的黑色氧化銅後,緩慢伸進集滿氫氣的錐形瓶口,可見銅絲很快變成紫紅色;隨即取出,銅絲又氧化變黑,再伸進錐形瓶,銅絲又變紅,可以如此反覆若干次。
現象:①黑色固體表面有紅色物質生成;②有小水珠生成
化學方程式:CuO+H
2=Cu+H
2O (加熱/△)
與酸反應
氧化銅在與稀硫酸或鹽酸反應時,會生成鹽和水
化學方程式:CuO+H2SO4=CuSO4+H2O
主要用途
化學方面:作氧化劑;氣體分析中測定碳;作為有機反應催化劑,製造人造絲和其它銅化合物。
工業方面:
用作玻璃、搪瓷、陶瓷工業的著色劑,油漆的防皺劑,光學玻璃的磨光劑。
用於人造絲製造工業及油脂的脫硫劑。
用作其他銅鹽製造的原料,也是制人造寶石的原料。
在磁性材料生產中用作鎳鋅鐵氧體及熱敏元件的原料。
其他:製造煙火、觸媒、及電鍍行業。
製取方法
實驗室製法
1、利用銅鹽如CuSO4與鹼(NaOH)反應生成Cu(OH)2 ,再將 Cu(OH)2 加熱分解以製得CuO。
CuSO4+2NaOH==Cu(OH)2↓+Na2SO4
Cu(OH)2=△=CuO+H2O
2、加熱銅(Cu),使銅與氧氣(O2)反應生成氧化銅(CuO)。
2Cu+O2==2CuO
工業製法
1、銅粉氧化法
以銅灰、銅渣為原料經焙燒,用煤氣加熱進行初步氧化,以除去原料中的水分和有機雜質。生成的初級氧化物自然冷卻,粉碎後,進行二次氧化,得到粗品氧化銅。粗品氧化銅加入預先裝好1:1硫酸的反應器中,在加熱攪拌下反應至液體相對密度為原來的1倍,pH值為2~3時即為反應終點,生成
硫酸銅溶液,靜置澄清後,在加熱及攪拌的條件下,加入鐵刨花,置換出銅,然後用熱水洗滌至無硫酸根和鐵質。經離心分離、乾燥,在450℃下氧化焙燒8h,冷卻後,粉碎至100目,再在氧化爐中氧化,製得氧化銅粉末。
 銅粉氧化法
銅粉氧化法2、硝酸銅熱分解法
將電解銅用稀硝酸溶解後在水浴上蒸乾,然後在乾燥器里要非常緩慢地從90℃加熱到120℃。當生成鬆軟的
鹼式鹽時,放入水中煮沸、過濾、乾燥;然後將其慢慢加熱到400℃,使大部分硝酸除去;接著粉碎後加熱到850℃,保持1h,使其分解為氧化銅。為使反應更加完全,可將產品再次粉碎,在約700℃的條件下,加熱1h後,放入乾燥器中冷卻。
3.碳酸銅熱分解法
將銅粉或銅線在通風櫥內用儘可能少的6mol/L
硝酸使其完全溶解,如果溶液不透明,則需過濾。另將碳酸鈉配成溶液與上述
硝酸銅溶液混合、煮沸生成黑色的鹼式鹽沉澱。當固體沉降後捨去上層清液,用傾析法充分洗滌、過濾、乾燥。將其放於蒸發皿上,在充分攪拌下用小火加熱,使其分解為氧化銅。
4.銅絲或銅粉硝化
將銅絲或銅粉溶於6mol/L硝酸中保持銅稍過量,加熱至溶液pH值3~4,以除去
氫氧化鐵沉澱,然後與10%( 質量)的
碳酸鈉溶液混合,加熱沸騰,有鹼式鹽析出,棄去上層清液,用水充分洗滌、過濾、乾燥。將乾燥的鹼式碳酸銅在充分攪拌下於小火加熱分解為黑色氧化銅粉末:CuCO
3·Cu(OH)
2=2CuO+CO
2↑+H
2O
當不再有二氧化碳生成,表明分解完全。
用電導水溶解高純硝酸銅,過濾,在清液中加入過量高純NH
3·H
2O,濾去雜質沉澱,濾液用高純硝酸中和至氫氧化銅析出。過濾,用電導水洗滌一次,再加硝酸溶解沉澱,加高純碳酸銨析出
碳酸銅,再洗滌,甩乾,在200℃烘箱內烘乾後,於450~550℃灼燒3~4h,得光譜純氧化銅:
 電導水溶解法
電導水溶解法化學口訣
火鹼宜用飽和液,全部變黑方停做。
相關解釋
1、三分之一適研缽:意思是說每次研磨時所裝藥品不能超過研缽容積的1/3(裝多了不僅研磨時灑出來,而且降低
研磨細度和
速率)
2、先慢後快圓周磨:意思是說研磨時杵頭要壓在研缽體上,始終作
圓周運動,開始時速度要慢,隨著藥品的破碎程度增大,可以適當加快研磨速度。
3、火鹼宜用
飽和液:意思是說,為了減少溶液的體積,最好用飽和的NaOH溶液。
4、全部變黑方停做:意思是說,直到全部變成了黑色固體時才停止加熱
危險與防控
危險性
健康危害:誤服或吸入大量氧化銅粉塵可能引起金屬煙熱,出現寒顫、體溫升高,同時可伴有呼吸道刺激症狀。長期接觸,可能引起呼吸道及眼結膜刺激、鼻衄、鼻黏膜出血點或潰瘍,甚至鼻中隔穿孔以及皮炎(以上病理反應未經證實)。
燃爆危險:該品不燃,屬於無氣味呈黑褐色穩定性物質。
防控
工程控制:密閉操作,局部排風。
呼吸系統防護:空氣中粉塵濃度超標時,必須佩戴自吸過濾式防塵口罩。緊急事態搶救或撤離時,應該佩戴空氣呼吸器。
眼睛防護:戴化學安全防護眼鏡。
身體防護:穿防滲透工作服。
手防護:戴橡膠手套。
其他防護:及時換洗工作服。注意個人清潔衛生。
注意事項
儲存
儲存於陰涼、通風的庫房。遠離火種、熱源。應與還原劑 、鹼金屬 、食用化學品分開存放,切忌混儲。儲區應備有合適的材料收容泄漏物。
運輸
起運時包裝要完整,裝載應穩妥。運輸過程中要確保容器不泄漏、不倒塌、不墜落、不損壞。嚴禁與還原劑、鹼金屬、食用化學品等混裝混運。運輸途中應防曝曬、雨淋,防高溫。車輛運輸完畢應進行徹底清掃。
操作
密閉操作,局部排風。操作人員必須經過專門培訓,嚴格遵守操作規程。建議操作人員佩戴自吸過濾式防塵口罩,戴化學
安全防護眼鏡,穿防毒物滲透工作服,戴橡膠手套。避免產生粉塵。避免與還原劑、
鹼金屬接觸。搬運時輕裝輕卸,防止包裝破損。配備
泄漏應急處理設備。倒空的容器可能殘留有害物。
處理方法
皮膚接觸:脫去污染的衣著,用流動清水沖洗。
眼睛接觸:提起眼瞼,用流動清水或生理鹽水沖洗。就醫。
吸 入:脫離現場至空氣新鮮處。如呼吸困難,給輸氧。就醫。
食 入:飲足量溫水,催吐。喝雞蛋清或牛奶,使金屬沉澱。就醫。
危險特性:未有特殊的燃燒爆炸特性。
滅火方法:消防人員必須穿全身防火防毒服,在上風向滅火。滅火時儘可能將容器從火場移至空曠處。
泄漏處理隔離泄漏污染區,限制出入。建議應急處理人員戴防塵面具(全面罩),穿防毒服。避免揚塵,小心掃起,置於袋中轉移至安全場所。若大量泄漏,用塑膠布、帆布覆蓋。收集回收或運至廢物處理場所處置。
常見謠言
C,H2 ,CO還原氧化銅吸熱
謠言實例:C+ 2CuO = 高溫= 2Cu + CO2↑吸熱反應
闢謠:判斷反應熱效應的兩個標準是實驗實測以及通過熱力學進行計算
計算過程:
反應1:CuO(s)+H2(g)=Cu(cr)+H2O(g)
反應2:CuO(s)+CO(g)=Cu(cr)+CO2(g)
反應3:CuO(s)+1/2C(石墨)=Cu(cr)+1/2CO2(g)
計算化學反應熱效應可以直接使用ΔH(例題見高等教育出版社《無機化學》上冊216頁),此處忽略溫度對ΔH的影響。
相應物質標準生成焓:(單位:kJ/mol)(數據出自高等教育出版社《無機化學》上冊427頁起的附表)
分子式 | 標準生成焓 |
H2O(g) | -241.82 |
C(石墨) | 0.00 |
H2(g) | 0.00 |
CO(g) | -110.53 |
CO2(g) | -393.51 |
Cu(s) | 0.00 |
CuO(cr) | -157.30 |
數據代入計算可知:
ΔH1=0+(-241.818)-(-157.3)-(0)=-84.518<0,即反應放熱
ΔH2=0+(-393.509)-(-110.525)-(-157.3)=-125.684<0,即反應放熱
ΔH3=0.5×(-393.509)+0-(-157.3)-0=-39.455<0,即反應放熱
綜上可證這三個反應都是放熱反應,即網路上流傳的所謂“C,H2,CO還原氧化銅(吸熱)”實質系謠言
安全信息
危險運輸編碼:UN 3077 9 / PGIII
危險品標誌:有害
計算化學數據
1、疏水參數計算參考值(XlogP):無
2、氫鍵供體數量:0
3、氫鍵受體數量:1
4、可旋轉化學鍵數量:0
5、互變異構體數量:無
6、拓撲分子極性表面積:17.1
7、重原子數量:2
8、表面電荷:0
9、複雜度:2
10、同位素原子數量:0
11、確定原子立構中心數量:0
12、不確定原子立構中心數量:0
 實驗製法
實驗製法 銅粉氧化法
銅粉氧化法 電導水溶解法
電導水溶解法
