一氧化碳是無色、無臭、無味、有毒的氣體,冰點-207℃,沸點-191.5℃。標準狀況下氣體密度為l.25g/L,和空氣密度(標準狀況下1.293g/L)相差很小,這也是容易發生煤氣中毒的因素之一。它為中性氣體。一氧化碳作為還原劑,高溫時能將許多金屬氧化物還原成金屬單質,因此常用於金屬的冶煉。
基本介紹
- 中文名:一氧化碳還原氧化銅
- 類型:化學實驗
- 原理:一氧化碳的還原性
- 實驗器材:鐵架台、酒精燈等
- 化學藥品:氧化銅、澄清石灰水、一氧化碳
實驗器材
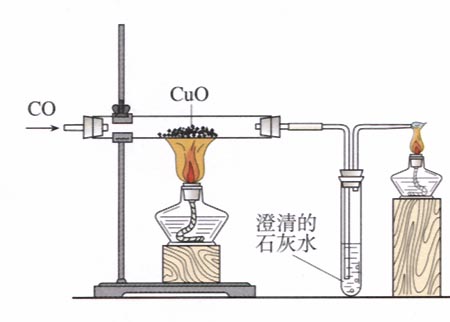
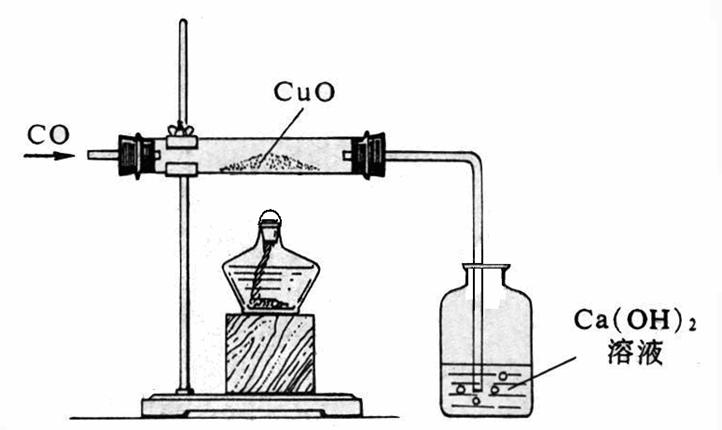
一氧化碳是無色、無臭、無味、有毒的氣體,冰點-207℃,沸點-191.5℃。標準狀況下氣體密度為l.25g/L,和空氣密度(標準狀況下1.293g/L)相差很小,這也是容易發生煤氣中毒的因素之一。它為中性氣體。一氧化碳作為還原劑,高溫時能將許多金屬氧化物還原成金屬單質,因此常用於金屬的冶煉。

一氧化碳的這一化學性質也與氫氣相類似,具有還原性,但也具有毒性可燃性,它將氧化銅還原成銅,同時生成二氧化碳氣體使澄清石灰水變渾濁。...
碳是一種具有還原性的非金屬。在一定條件下,用碳可以還原氧化銅生成銅單質。...... 碳是一種具有還原性的非金屬。在一定條件下,用碳可以還原氧化銅生成銅單質。...
原理:氧化銅(灼熱)可以和氫氣(H₂)、碳(C)、一氧化碳(CO)等具有還原性物質反應,生成銅+X(氧化物)。一、碳還原 用品:試管、單孔塞、酒精燈、鐵架台、木炭...
氧化鈷(cobaltous oxide),化學式CoO。為黑灰色六方晶系粉末。相對密度6.45。溶於酸,不溶於水,醇,氨水。易被一氧化碳還原成金屬鈷。高溫時易與二氧化矽、...
氧化鐵(H2+CuO=Cu+H2O ; 3H2+Fe2O3=2Fe+3H2O); 炭還原氧化銅(C+2CuO=2Cu+CO2); 一氧化碳還原氧化銅、氧化鐵(CO+CuO=Cu+CO2 ; 3CO+Fe2O3=2Fe+...
碳在充足的氧氣中燃燒:煤氣工作原理:天然氣工作原理:實驗室用大理石和鹽酸製取二氧化碳: 碳還原氧化銅:熟石灰檢驗二氧化碳:氫氧化鈉與二氧化碳反應: ...
如氫氣、木炭或者一氧化碳還原氧化銅都是典型的放熱反應。(6)NaOH或濃硫酸溶於水(注:這兩點只是說會放熱,但嚴格說起來並不算化學反應,考試時應注意)...
19.一氧化碳還原氧化銅:CO+ CuO 加熱 Cu + CO220.一氧化碳還原氧化鐵:3CO+ Fe2O3 高溫 2Fe + 3CO221.二氧化碳通過澄清石灰水(檢驗二氧化碳):Ca(OH)2 ...
21.鐵和硫酸銅溶液反應: 22.氫氣還原氧化銅:23. 鎂還原氧化銅:化學方程式碳和碳氧化物 (1)碳的化學性質24. 碳在氧氣中充分燃燒:...
28氫氣還原氧化銅 29碳和二氧化碳反應 30氧化還原反應(從得氧失氧角度) 第3章金屬和金屬材料 31鎂與鹽酸反應 32鋅與鹽酸反應 33鐵與鹽酸反應 34鋁...
1.木炭還原氧化銅 2.炭的吸附性 3.質量守恆定律 4.一氧化碳還原氧化銅 5.鐵絲在氧氣中燃燒 6.空氣中氧氣含量的測定 7.氫氣的還原性、可燃性實驗 ...
實驗6一氧化碳還原氧化銅 實驗7製取二氧化碳 第六單元燃料及其利用 實驗1燃燒條件的探究 實驗2滅火的原理 實驗3麵粉爆炸 實驗4甲烷的燃燒 實驗5鎂和鹽酸...
白磷燃燒前後質量的測定 一氧化碳還原氧化銅 探究溶液酸鹼度對頭髮的影響 鐵釘跟硫酸銅溶液反應前後質量的測定 酸與鹼的反應 飽和溶液的製取 鋅粒和稀硫酸反應及...
