氟氧化合物,顧名思義就是氟和氧組成的化合物。
由於氟和氧都是非金屬性很強的元素,通常情況下它們不能直接反應,因而氟氧化合物比較少見,同時它們的性質也和普通的氧化物有很大不同。
所有的氟氧化合物都是共價化合物,都是很強的氧化劑和氟化劑。
已知的氟氧化合物有:嚴格來說只有二氟化氧,二氟化二氧,二氟化三氧,二氟化四氧,二氟化五氧,二氟化六氧。象次氟酸,氧的O2+鹽以及一些次氟酸的衍生物可以看作是氟氧化合物的延伸,因為這些化合物裡邊不但有氟和氧,還包含其他元素。
基本介紹
- 中文名:氟氧化合物
- 化學式:OF2,O2F2,O2PtF6等
- 水溶性:與水反應
- 套用:作強氧化劑
- 安全性描述:有毒
- 危險性符號:有毒
常見的氧氟化合物
1.二氟化氧,分子式 OF2
二氟化氧是最早發現的氟氧化物。為無色無味的有毒氣體,攝氏200度開始分解,產物為氧氣和氟氣,250度迅速分解。是最穩定的氟氧化合物。因為其熱穩定性好,所以其活性和氧化性弱於氟,氧化還原電位為2.2。
二氟化氧是很強的氧化劑和氟化劑,常溫下可以將氮氣氧化,生成物為三氟化氮和二氧化氮,可以將惰性氣體氙氧化成+4價,可以和氫氣反應,生成水和氟化氫,緩慢水解,產物為氟化氫和氧氣。也可以和絕大多數金屬和非金屬反應。
二氟化氧不能通過氟和氧直接化合製取,通常用氟通過2%的氫氧化鈉溶液獲得,或者電解10%的氟化鈉溶液得到
2F2 + 2NaOH==2NaF + H2O + OF2↑
這個反應中,氫氧化鈉溶液的濃度必須是百分之二,否則會有其他產物,比如氧氣,臭氧產生。
2.二氟化二氧,分子式O2F2
O2F2的製取和性質同O3F2,O4F2,O5F2,O6F2基本一樣,所以把它們歸位一類。
其中,O4F2,O5F2,O6F2因為極其不穩定,分子結構還沒有完全確定。
它們的製取方法:
將氧氣和氟氣的混合物冷卻,全部液化,然後進行輝光放電合成,隨著氟和氧的量和反應的控制條件的變化,反應產物也有不同,分別是O2F2,O3F2,O4F2,O5F2,O6F2。它們的合成條件如下表所示:
這幾個氟氧化合物,隨著含氧原子的增多,性質越來越不穩定,氧化性也隨著越來越強。比如O2F2,零下160度開始分解,到零下95度分解速度明顯加快,而到了零下57度立即分解完畢。而O6F2在零下213度合成後就會開始分解,到零下183度會迅速分解完,產物為氟氣和氧氣,以及少量的臭氧。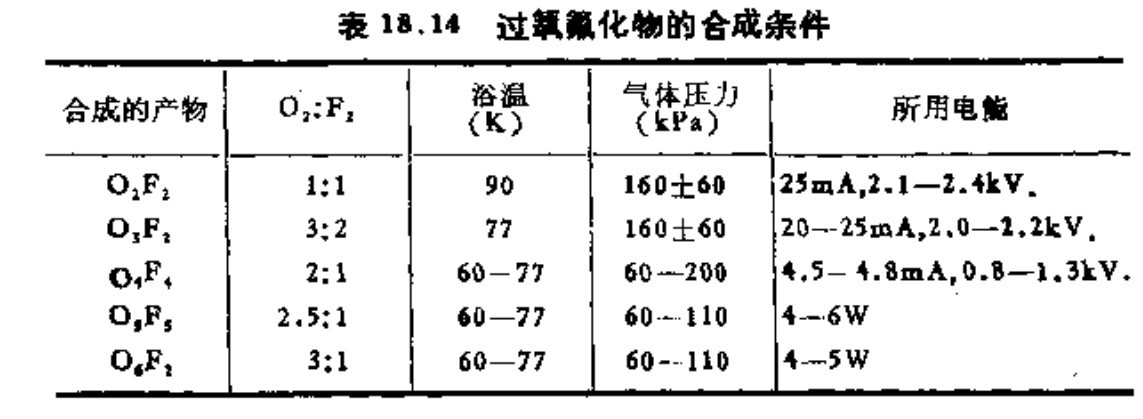

化學性質:由於以上幾個氟氧化物均不穩定,對它們的研究都不多,其中O2F2的研究多一些。它們均是很強的氧化劑和氟化劑。氧化性隨著含氧原子的增多而增強。氧化能力介於氟氣分子----氟原子之間,基本和氟原子相當了。
以二氟化二氧為例:
二氟化二氧是一種性質極其不穩定的化合物,即使在-160℃的情況下也能緩慢分解氟氣和氧氣。分解速率約為每天4%。二氟化二氧只能在-57℃以下穩定存在。其性狀為黃色晶體(熔點以下)和黃色油狀液體(熔點以上)。
二氟化二氧的氧化性極強,基本和氟原子的氧化性相當。在低於-100℃的極低溫度下也能與所有的金屬和非金屬反應(氦氖氬除外)。 如二氟化二氧可以將黃金氧化成+5價,將硫元素從0價氧化成+6價,將惰性氣體氙,從0價氧化成+6價,甚至能將一部分氟離子氧化成氟單質。O2F2還能和惰性氣體氪發生反應,生成二氟化氪和氧氣
O2F2+Kr===KrF2+O2 反應條件:零下160度,日光照射或者紫外線照射
這也說明二氟化二氧的極強氧化性,而且這個反應不可逆。即O2F2的氧化性與KrF2的氧化性相當或者更強。
這個反應實質是利用O2F2的不穩定,會分解成氧氣和氟氣,同時零下160度的時候氪也處於液態,有比氣態強的多的活性。而且在光照狀態,氧原子和氟原子都是處於激髮狀態,擁有平時強的多的奪取電子的能力。特別是氟原子獲得了比平時更強的氧化能力,從而從氪那裡搶的電子。(注意此時氧氣為氣態,氟原子的氧化能力不能奪取氣態氧分子中的電子,而氪在零下157度即被液化,物質在液態活性最大)
氟原子的氧化電位,為3.057,有些資料認為是3.03,二氟化二氧應該和這一數據很接近,或者相當。二氟化氪也和氟原子的氧化性差不多。
3.氧的正價鹽,即O2+
第一個含有O2+離子的化合物是在1962年獲得,即用六氟化鉑蒸汽和氧氣反應,獲得六氟合鉑酸二氧。氧為+1/2價,即一個氧氣分子失去一個電子,而不是一個氧原子失去一個電子。需要注意的是這個反應必須是六氟化鉑蒸汽,才能和氧氣化合,固態的不行。
之後陸續發現的O2+化合物有,O2AsF6 O2BF4 ,O2SbF6等幾個。其中,六氟化鉑,三氟化硼,五氟化砷,五氟化錫,五氟化銻都是強的路易斯酸,有很強的親氟性,所以才會產生O2+的鹽,其他元素沒有這樣的性質。
如:氟本來沒有能力直接將氧氣氧化,當有強路易斯酸五氟化砷存在的情況下,由於五氟化砷的親氟性,增強了氟的氧化性,導致反應可以發生:
O2+F2+AsF5====O2AsF6 反應條件:高溫或者強光照射,五氟化砷起了催化作用,同時也參與反應。
O2+化合物的性質:
結構表明O2+離子中的氧O----O比氧氣分子中的O---鍵長要短,所有的二氧基鹽都是順磁性的。二氧基鹽都不穩定,常溫迅速分解,只有六氟合砷酸二氧和六氟合銻酸二氧比較穩定,在有惰性氣體存在的情況下100度以上才會分解。所有的二氧基鹽都是很強的氧化劑,氧化性和氟相當。都會和水發生水解反應,放出氧氣和少量的臭氧。
4.次氟酸及其衍生物
次氟酸,化學式 HOF
1971年美國的化學家斯圖爾傑和阿佩里曼在0℃以下,用被氮氣稀釋的氟氣在細冰上緩慢通過製得。該物質極為不穩定,容易爆炸分解,分解產物為氟化氫和氧氣。在乙腈中卻相對穩定的多。
該化合物中,氧為零價,氟為-1價,氫為+1價。次氟酸的真實架構是H-O-F,即氧通過單鍵分別和氫以及氟相連。
但是所謂的正負化合價其實是一個很古老也很迂腐的概念,在後來尤其是有機中根本不會用到。
因為正負化合價的規定對於共價鍵來說,看共用的電子對偏向哪邊。偏向的那個原子算帶負電多一些算負價。
所以,氧吸引電子的能力比氫強,和氫結合的時候算+1,而又比不過氟,和氟結合算-1,算在一起是就出現了尷尬的0價。
次氟酸有較強的酸性和氧化性,酸性和鹽酸差不多,氧化性和氧氣接近,可以氧化碘離子。次氟酸見水分解,沒有水溶液。
關於次氟酸的研究以及套用都不多
次氟酸的衍生物:如CF3OF、 SF5OF 、NO2OF等都是已知的,但涉及的研究以及套用很少。
