生物解釋
人和哺乳動物體內的脂肪組織可分為白色脂肪組織和棕色脂肪組織。前者就是我們通常認識的那種脂肪,廣泛分布於皮下組織和內臟周圍。棕色脂肪組織存在於人和所有哺乳動物體內,但主要是在新生兒和幼小的哺乳動物體內。
這兩種脂肪組織與白色脂肪組織既然都叫“脂肪組織”,它們的共同點當然就是細胞內都含有脂肪。它們的區別在於,棕色脂肪組織的細胞體積較小,細胞中脂肪顆粒較小,卻含有大量線粒體,細胞周圍有豐富的毛細血管,交感神經纖維直接到達棕色脂肪組織的細胞膜上。
外表不同、結構不同,它們在能量代謝中所起的作用也截然相反。白色脂肪組織是能量倉庫,它的作用是將多餘的能量以脂肪的形式儲藏起來;棕色脂肪組織則是通過它細胞內大量的線粒體將食物中的能量轉化成熱能。棕色脂肪細胞的線粒體有一種稱為解耦聯蛋白1(UCP1)的物質,這種物質使得葡萄糖和脂肪酸分解產生的能量不能轉化為ATP(為生物體直接供能的物質),而只能轉化為熱能。這就是為什麼棕色脂肪組織較多存在於新生兒和幼小哺乳動物體內的原因:因為小傢伙們剛生出來,身體的調節功能還比較差,不能通過“打哆嗦”(肌肉顫慄)這種方式產熱來抵禦外界的寒冷,所以需要棕色脂肪組織的幫助。打個比方來說,白色脂肪組織就好比被子,可以起保暖的作用;棕色脂肪組織就好比電熱毯,通過產熱來幫助機體抵禦寒冷。
功能
棕色脂肪組織,是哺乳動物體內非顫慄產熱的主要來源,對於維持動物的體溫和能量平衡起重要作用,對幼齡哺乳動物尤為重要。
能量攝入超過能量消耗導致超重和肥胖是影響能量平衡的主要原因,由解偶聯蛋白調控食物誘發脂肪組織和肌肉的生熱作用也影響能量平衡,它是額外的耗能並阻止超重和肥胖(Samec,1998)。吃相同的東西,有的人胖,有的人瘦,有些人雖然瘦小但食量卻大得驚人,在相同低溫環境下,有的幼畜死亡率很高,有的卻表現出適應。出現這些差異與機體中棕色脂肪組織(brownadiposetissue,BAT)的差異有關。大量的研究表明棕色脂肪組織不僅具有禦寒功能,而且還會燃燒多餘脂肪和糖分,產生熱量,防止體內儲存過多的脂肪。
分布概況
1BAT的概況
人和哺乳動物體中的脂肪組織分為棕色脂肪組織(BAT)和白色脂肪組織(WAT)。BAT因其細胞內含有大量血紅蛋白和高水平的血紅素卟啉,細胞呈棕色而得名。BAT在所有哺乳動物體中都存在,主要是幼小哺乳動物體中,而在成熟的哺乳動物體中僅有少量存在。BAT細胞體積比WAT小,細胞表面密布交感神經纖維,細胞中脂肪顆粒很少,此種組織細胞內含有大量線粒體,細胞周圍含有豐富毛細血管,這與其產熱功能相匹配。WAT與BAT在能量代謝中發揮著截然相反的作用。WAT主要是通過甘油三酯貯存能量,而BAT則通過產熱來消耗能量。早在1961~1964年,人們就發現齧齒動物能利用體內棕色脂肪組織,對寒冷刺激、休眠、採食誘導,營養不足(低蛋白質)時,產生熱量維持體溫十分重要(Smith等,1961)。有研究發現BAT在成年人或成年動物體中已經消失,但近年來的研究表明,戶外工人和長期飲酒人群的頸動脈周圍和心包存在BAT,成人的一些部位的脂肪組織檢測到了UCP1(解偶聯蛋白1)及其RNA,還有一些研究指出,成人脂肪組織中有大量的棕色脂肪細胞分布並表達UCP。
非顫慄性產熱(NST)對哺乳動物在冷環境下的生存是必需的,棕色脂肪組織是哺乳動物體內非顫慄產熱的主要來源(Smith等,1969;Nicholls等,1984;Himms等,1990)。對於哺乳動物和人,棕色脂肪組織主要分布在:①肩胛間區;②腹部大血管及周圍;③肌肉、頸部血管及腎周、胸部動脈和下腔靜脈周圍分布小塊棕色脂肪組織。這種組織的主要功能是通過非顫慄產熱維持動物的體溫及能量平衡,BAT對於維持動物的體溫和能量平衡起重要作用,對幼齡哺乳動物尤為重要(Himms等,1990;Jansky等,1995)。
產熱機制
2BAT產熱機制——去甲腎上腺素(NE)控制產熱
哺乳類動物BAT活動的最終目的是產生熱量。BAT主要作用是調節機體溫度,參與能量的消耗,因而與保持機體重量也有關。
2.1去甲腎上腺素對BAT的快速作用——控制產熱
去甲腎上腺素是交感神經的主要遞質,冷暴露條件下,交感神經末梢釋放NE激活組織,是產熱增加的生理基礎(HimmsHagen,1990;Baumuratov等,2003;Baumuratov等,2005)。寒冷刺激,脂肪細胞周圍交感神經末梢釋放的去甲腎上腺素,通過作用於棕色脂肪細胞上的受體,使細胞內cAMP濃度發生改變,最終影響甘油三酯分解為甘油和脂肪酸。
機體中的腎上腺素能受體(AR)有α、β兩種,其中β分為β1、β2、β3,β1在成熟的棕色脂肪組織中表達;β2在棕色脂肪組織中沒有表達;β3在棕色脂肪組織和白色脂肪組織中都有表達。每種受體的作用方式和機理不同。
NE信號主要通過β3腎上腺素能受體控制產熱(HimmsHagen等,1990;Smith等,2004;Oana等,2006),NE通過作用於棕色脂肪細胞上的β3腎上腺素能受體,與Gs蛋白偶聯活化腺苷酸環化酶(AC),使細胞內cAMP濃度增加,從而激活cAMP依賴的PKA,後者使敏感脂酶磷酸化,最終使促進脂滴中貯存的甘油三酯分解為甘油和脂肪酸(見圖1);PKA使cAMP反應元件結合蛋白(CREB)磷酸化,成為有活性的形式,有活性的CREB能直接誘導PPAR激活UCP1和PGC-1α的表達。這種生熱主要是通過脂解作用激活了UCP1,是大多數哺乳動物的主要生熱方式。但是對於像豬這樣的BAT中缺乏β3腎上腺素能受體的動物的產熱方式則主要是通過β1腎上腺素能受體的作用(Atgie等,1996;Himms-Hagen等,1995)。NE刺激BAT,β1腎上腺素能受體表達增加,使交感神經緊張,從而產熱。α2腎上腺素能受體抑制產熱(McMahon等,1982),NE通過作用於棕色脂肪細胞上的α2腎上腺素能受體,與Gi蛋白偶聯,抑制腺苷酸環化酶(AC),使細胞內cAMP濃度降低,抑制產熱(見圖1)。α1腎上腺素能受體作用方式:NE刺激或冷暴露,α1腎上腺素能受體增加,使線粒體內Ca2+濃度增加,增加產熱,這種產熱可能還是與cAMP有關(Zhao,1997;Baumuratov等,2005)。Ca2+在此扮演著第三信使的作用,類似於cAMP(Baumuratov等,2005)。
2.2去甲腎上腺素對BAT的慢性作用
去甲腎上腺素對BAT的慢性作用主要是引起棕色脂肪細胞的增殖和分化。
2.2.1細胞增殖
1964年Camerond等就發現動物在寒冷環境中BAT分裂指數增加,10d左右細胞內DNA含量可增加3~4倍。給小鼠和大鼠注射NA(核酸)也可產生類似的變化(Rehnmark等,1989;Geloen等,1990)。為了進一步研究這個過程,Bronnikov等(1992)用原代培養的棕色脂肪細胞進行研究。細胞在含有小牛血清的培養基中可自然分裂,通常在6d左右就可達到融合。在細胞融合前的增殖階段,NA可明顯增加DNA合成。在無小牛血清環境下,培養細胞不出現自然分裂,此時NA也能明顯刺激DNA合成。這表明NA確實具有促進棕色脂肪細胞增殖的作用。一些能促進細胞內cAMP濃度增高的物質都可通過與NA類似的方式增加DNA合成。因此可以說cAMP是非成熟細胞增殖的信使。
2.2.2細胞分化
在生理性誘導的募集反應中,也出現細胞分化程度的增高,表現線上粒體生成增多和UCP基因表達增加,這些變化可增加組織的產熱能力。細胞分化的調節也可用培養細胞來研究。NA可增加UCPmRNA的表達和細胞內UCP的含量,這種刺激反應在細胞融合期最為明顯(Rehnmark等,1990)。利用能增高細胞內cAMP濃度的物質(如forskolin或cAMP的類似物)也能引起相同的反應,很明顯NA引起基因表達主要是由β-AR介導。因此在成熟棕色脂肪細胞,NA通過激活β3-AR和cAMP增高誘導基因的表達,cAMP也是棕色脂肪細胞分化的信使。cAMP引起非成熟細胞DNA的合成,在成熟細胞中則引起UCP的表達。
解偶聯蛋白
3BAT與解偶聯蛋白
線粒體內膜的解偶聯蛋白(UCP)是決定BAT功能的關鍵因素(Heaton等,1978)。UCP是參與能量代謝的重要蛋白質。解偶聯蛋白是一種在棕色脂肪組織特異表達的線粒體內膜蛋白質,分子量為32kDa。UCP的作用是作為脂肪酸陰離子轉運載體。
3.1UCP解偶聯作用
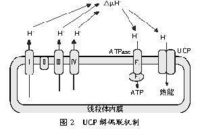
電子傳遞鏈產生H+跨線粒體內膜的勢能。在偶聯狀態下,勢能驅使H+通過ATP合成酶而重新回到線粒體基質中,同時將勢能轉化為ATP的化學能。由於UCP線上粒體內膜上有特殊的通道,由電子傳遞鏈泵出的氫離子直接通過這種通道流回線粒體內,使跨線粒體內膜的質子電化學梯度消失,ADP不能進行磷酸化形成ATP,物質氧化與ATP生成脫偶聯,即質子滲漏,而成為產熱過程,能量以熱能形式釋放,減少了ATP合成(Lowell等,1997;Boss等,2000)(見圖2)。
3.2UCP分類
UCP有五大類,UCP1主要存在於棕色脂肪組織中,UCP2廣泛分布於組織器官中(包括棕色和白色脂肪組織),UCP3分布在骨骼肌和BAT中,UCP4和UCP5主要分布在中樞神經系統中。在棕色脂肪組織中存在的只有UCP1、UCP2和UCP3。UCP1在嚙齒類動物中的主要作用是產生熱量以維持體溫及能量穩態,在控制體重和脂肪含量中有重要作用;UCP2主要阻止脂肪酸氧化和脂質的累積(Yu等,2000);UCP3非顫抖的生熱作用(Jezek,1998)。近年來的研究表明,UCPs不僅與組織的產熱有關,而且關係到個體的代謝方向與速率(Nisoli等,1998)。UCP2、UCP3基因突變小鼠表現出肥胖與糖尿病;敲除UCP1基因的小鼠雖不表現為肥胖,但表現出明顯的畏寒傾向(Nisoli等,1998)。
3.3UCP的主要生理作用
3.3.1調控線粒體合成ATP與產熱
UCP具有解偶聯活性,能降低線粒體膜電位,限制ATP合成,增加產熱,調節機體產熱,維持體溫。UCP介導H+內流,使能量以熱量的形式散發,有助於維持機體體溫。UCP1主要分布於棕色脂肪組織(BAT)中,BAT是產熱的主要組織。通過基因敲除技術,使小鼠UCP1基因失活後,其對寒冷不耐受(Nisoli,1998)。
3.3.2調節細胞呼吸及NAD+/NADH比例
當能量底物供應過量、ATP水平增高或當ADP不足時,線粒體呼吸受到抑制,NAD+/NADH比例降低,UCP使線粒體膜電位低於某一閾值,限制ATP的產生,促進細胞呼吸,維持NAD+/NADH比例,對合成脂肪、生酮及胺基酸代謝均有重要作用。
3.3.3抑制ROS(活性氧)的生成
ROS的產生與△μH+呈正相關,線粒體外膜的質子回流減少,引起△μH+提高,導致線粒體呼吸鏈的電子傳遞阻力增大,抑制電子沿呼吸鏈傳遞,使電子易發生泄漏而產生O2-·。這樣當ADP下降,ATP合成減少、△μH+提高時,ROS產生增加,導致氧化應激增強(Fleury等,1997)。脂肪酸β氧化增強時,UCP2和UCP3的mRNA水平升高。脂肪過度氧化使ROS過量產生,UCP2、UCP3可能會通過解偶聯作用,防止△μH+的過度提高,使ROS產生減少。UCP2和UCP3在脂肪酸代謝中的作用可能也是減少脂肪酸過度代謝產生的ROS。此外寒冷會增加ROS的產生,而寒冷也會誘導UCP1的表達,所以寒冷增加UCP1來產熱,可能只是UCP1抑制ROS的副作用(Fleury等,1997)。因此可以認為UCP最直接、最本質的功能可能還是抑制ROS,而其它的功能只是這一功能所產生的結果(Fleury等,1997)。
PGC1α關係
4BAT與PGC-1α
過氧化物酶體增殖物激活受體γ輔助激活因子(PGC-1α)是誘導棕色脂肪細胞UCP1高表達的重要激活因子。PGC-1α主要在棕色脂肪細胞表達,而白色脂肪細胞表達極少(Liu等,2004)。PGC-1α與棕色脂肪細胞的分化及其生理功能關係密切,是調控機體能量代謝的重要基因。在調節肝糖異生、骨骼肌葡萄糖轉運、胰島素敏感性、適應性產熱、線粒體功能、脂肪酸β氧化、脂肪細胞分化、膽固醇逆向轉運等方面發揮重要作用(Michae等,2001;Boustead等,2003;Louet等,2002)。
4.1PGC-1α與能量代謝的關係
在寒冷、有氧運動和禁食條件下,交感神經興奮誘導BAT內PGC-1α表達,提高UCP1水平,從而增加了機體能量消耗(Pierre,2003)。敲除棕色脂肪細胞PGC-1α基因後,其線粒體呼吸鏈功能酶及脂肪酸氧化功能明顯降低;冷刺激下,PGC-1α基因敲除鼠UCP1停留在基礎水平(Nedergard,2001)。遺傳引起的肥胖症,比如ob/ob、db/db、fa/fa肥胖大鼠,其棕色脂肪細胞的PGC-1α及UCP1含量明顯減少,脂肪酸β氧化的酶活性降低,能量代謝率下降。可見棕色脂肪細胞PGC-1α及UCP1表達異常參與了肥胖症的產生(Prpicv,2003)。
4.2PGC-1α誘導脂肪代謝和細胞分化
在培養的小鼠初代肝細胞中瞬時轉染PGC-1α可激活肉毒鹼棕櫚醯基轉移酶Ⅰ(CPT-I,脂肪酸β氧化的限速酶)基因的表達,激活肝臟脂肪酸β氧化(Louet等,2002)。當PGC-1α被導入白色脂肪細胞後,從而使WAT細胞具有BAT細胞的特徵,能誘導UCP1基因的表達和線粒體的合成,後兩者決定著棕色脂肪細胞特異性分化(Tiraby等,2003)。PGC-1α是腎上腺素信號途徑的下游靶點,而後者是決定體外培養細胞在寒冷刺激下棕色脂肪細胞定向分化的關鍵調節因子。PGC-1α能誘導WAT向BAT轉化,促進BAT產熱耗能。因此,定向誘導PGC-1α在WAT表達,增加白色脂肪細胞內脂質氧化,加大機體能量消耗,可能是進一步研究減肥治療的一個方向。
4.3PGC-1α促進BAT和骨骼肌細胞產熱
PGC-1α在誘導BAT和骨骼肌細胞產熱耗能過程中發揮了重要作用。其主要機制在於:第一,促進線粒體合成。PGC-1α通過與核呼吸因子1、2(NRF-1和NRF-2)結合,促進了線粒體轉錄因子A(mtTFA)的激活,後者是線粒體生物合成的重要轉錄激活因子。第二,促進脂肪酸氧化及線粒體的解偶聯呼吸。在脂肪酸β氧化過程中,肉毒鹼棕櫚醯基轉移酶Ⅰ(CPT-I)、長鏈酯醯CoA脫氫酶和中鏈酯醯CoA脫氫酶,尤其是CPT-I是該流程中的關鍵酶。另外,PGC-1α通過和PPAR、甲狀腺激素受體、維甲酸受體相互干擾,形成視黃醇複合物,啟動了UCP1的基因轉錄和轉錄後加工過程,進而促進了線粒體的解偶聯呼吸。
影響因素
5影響BAT含量及功能的因素
5.1遺傳的因素
不同的動物品種BAT在代謝上有差異。Smith等(2004)用NE灌注Brahman(B)(高死亡率品種)和Angus(A)兩個品種牛的BAT組織,結果發現高死亡率B品種BAT中β受體的含量是A品種的2~3倍;用NE灌注兩個品種牛的BAT組織,用棕櫚酸做合成脂肪的原料,發現BAT中脂肪的生成A顯著高於B;出生後冷暴露48h,B品種的BAT收縮,而A品種沒有,B品種的BAT很快耗盡;體外培養,發現A品種皮下BAT先於B發育,說明A品種有較大的產熱能力。可以看出高死亡率B品種BAT分解旺盛,但不持久,脂肪的合成能力差,導致冷適應下死亡率高(Landis,2002)。
隨年齡的增加,BAT減少,剛出生的嬰兒,棕色脂肪組織約有100g,然而到了青春期左右開始減少,最後減至40g左右,但並不會完全消失。在胚胎髮育的不同時期,BAT發育也有差異。特別是在出生前14~24d,BAT細胞的體積增大,分娩前的棕色脂肪細胞,線粒體拉長,且高度盤繞,嵴高度分化,BAT中線粒體增加,UCP的表達增加。BAT的形態學和UCP的表達變化為胎兒脫離母體做準備。
5.2季節和氣溫
季節和氣溫影響動物BAT的含量。Dew等(1998)對一種冬眠的小型哺乳動物研究發現BAT細胞中線粒體冬天比夏天多,脂肪滴冬天比夏天小。羔羊冷暴露48h,BAT中脂肪全部耗盡(Landis,2002)。
5.3營養因素
5.3.1能量
高能日糧可使BAT基因表達和沉積發生變化,促進UCPmRNA的表達(Surwit,1998),顯著增加大鼠BAT的重量和降低血清甘油及甘油三酯濃度。高能日糧調控BAT-UCP1mRNA、UCP3mRNA的表達機制一樣,可能是影響β3腎上腺激素(Savontaus,1998)、瘦素(Scarpace,1998)、甲狀腺激素(Larkin,1997)和寒冷刺激(Boss,2000)對UCP1mRNA、UCP3mRNA的調控作用,顯著增加BAT-UCP1mRNA、UCP3mRNA水平,但不影響UCP2mRNA的表達。高能日糧增加脂肪沉積,促使血清瘦素升高(Javier等,2001),抑制食物食入和增加能量消耗,促進BAT-UCP1mRNA的表達(Scarpace等,1998)。Marcia等(1992)發現,飼餵高蛋白質和高碳水化合物的日糧,BAT的產熱能力下降。
餵養含有較高水平多不飽和脂肪酸的高脂飲食導致棕色脂肪產熱活性增加及BAT-UCP1mRNA表達增加,而且富含n-3多聚不飽和脂肪酸(PUFA)日糧比富含n-6PUFA的日糧增加BAT-UCP1mRNA表達(Takahashi,2000),使BAT-UCP基因表達增加2~3倍(Takahashi,1999)和BAT-UCP1、BAT-UCP2分別增加4倍、3倍(Rippe等,2000)。但用熟豬油餵養成年大鼠4周,結果發現大鼠飲食量略有下降,體重無明顯增加;肩胛間棕色脂肪體積無明顯變化,顏色無改變;對棕色脂肪線粒體上UCP無明顯影響。可能的原因是:①多不飽和脂肪酸比飽和脂肪酸能強烈地刺激交感神經系統;②改變飲食中多不飽和脂肪酸水平,可能改變了膜的功能,如受體-酶偶聯和激素敏感性,多不飽和脂肪酸對偶聯程度有重要影響;③多不飽和脂肪酸可能直接影響棕色脂肪,如亞油酸可能優先運輸到棕色脂肪,通過脂肪酸急性影響質子通道,導致線粒體氧化呼吸解偶聯增加(Matsuda等,1997)。Encinias等(2004)給懷孕50d的母羊補飼亞油酸,提高羔羊的成活率2.9%(P=0.03),但不提高斷奶重和BAT的沉積。
限食或飢餓會降低BAT的活性,可能的原因是降低了交感神經的刺激,降低了UCP的表達(Young等,1982;Rothwell等,1982)。給小鼠或大鼠飲用酒精水可以增加BAT的含量(Huttunen等,1988、1990;Elsukova等,2001)。
5.3.2蛋白質
給小鼠或大鼠飼餵低蛋白日糧可以增加BAT募集,UCP表達增加(Glick等,1981、1983、1984、1985;LeBlanc等,1997;Specter等,1995)。而飼餵高蛋白質和高碳水化合物的日糧,BAT的產熱能力下降(Marcia等,1992)。可能是因為低蛋白日糧,增加了動物的採食量,導致動物肥胖,使機體中瘦素含量增加,增加了對棕色脂肪調控中心的刺激,從而增加了BAT募集,使能量的利用效率下降,反過來抑制肥胖的發生。
5.3.3微量元素
適量補鋅可以通過增加棕色脂肪組織線粒體中UCP含量,提高機體的耐寒力。補鋅以及冷暴露未改變大鼠血漿鋅水平,但可以使肝臟和肌肉中鋅水平明顯升高,說明補鋅可以提高冷暴露大鼠的組織鋅水平(駱文靜等,2004)。關於鋅可以提高大鼠耐寒力的機制目前還不確定。有學者認為由鋅組成的許多酶的活性基團可以抑制自由基的產生,保護細胞膜和蛋白免受自由基的氧化損傷,從而提高機體的耐寒力。
5.3.4維生素
妊娠後期補充維生素E可能會通過提高胎兒BAT的量,而影響胎兒的能量狀況(Nockels等,1996;Thomas等,1995)。苗振春等(2001)報導了全反式維甲酸(tRA)對棕色脂肪組織的影響,tRA能使棕色脂肪組織線粒體中UCP含量增加,但不改變其活性;能增加棕色脂肪組織中脂肪消耗,可能在白色脂肪組織中誘導產生UCP。Puigserver等(1996)發現用tRA處理大鼠,其肩胛間BAT體積明顯變小,BAT中總蛋白含量減少,但特異性UCP卻增加2倍,說明tRA能引起UCP含量增加,同時增加脂肪消耗,但其確切機制仍不明確,有待進一步研究。
5.3.5母體營養的影響
孕期1~2周,母老鼠營養不良,子宮內營養不良,使雄性子鼠增重和脂肪沉積下降,儘管正常採食,但血漿中TG濃度下降;使雌性子鼠BAT重量和蛋白質含量下降,細胞色素C氧化酶活力下降,表現為低交感神經活動(Anguita,1993)。Luz等(2003)報導給孕期母鼠限食(50%),子鼠出生後耐寒冷的能力差。由於子宮內營養不良,可能推遲下丘腦-甲狀腺軸的發育,反過來影響BAT的發育,導致新生兒產熱不足。
5.3.6激素和轉錄因子
凡是能夠引起UCP1和PGC-1α表達發生改變的激素,都可能影響BAT。如甲狀腺素、去甲腎上腺素、胰島素、視黃酸、皮質酮、過氧化物酶受體和轉錄因子TAGA2蛋白等。轉錄因子TAGA2蛋白抑制棕色脂肪中PGC-1α和UCP1的表達(Tsai,2005)。
結語
6結語
動物與環境之間的關係一直是動物學家們所關心的問題,動物只有與環境條件相協調相適應才能夠順利生存下去。動物對環境的適應是一個能動的過程,動物通過啟動與抗冷性有關的基因表達,給出在逆境中的保護措施,才能協助動物自身渡過難關。生物機體形成冷適應後,表現出基礎代謝或非寒顫性產熱增加。對棕色脂肪組織產熱機理和代謝的研究,可以擴大動物生態位和動物對環境驟然變化的適應能力,對提高幼畜的成活率十分重要。BAT中的UCP1和PGC-1α可調節能量平衡及底物代謝,影響肥胖的發生,選擇性提高UCP1和PGC-1α活性是減肥的有效方法,可為肥胖的治療研究提供理論依據。總之,弄清BAT的功能對發展畜牧業和人類健康都具有重要的現實意義。