疫苗介紹
核酸疫苗(nucleic acid vaccine),也稱
基因疫苗(genetic vaccine),是指將含有編碼的蛋白基因序列的質粒載體,經
肌肉注射或微彈轟擊等方法導入宿主體內,通過宿主細胞表達抗原蛋白,誘導宿主細胞產生對該抗原蛋白的免疫應答,以達到預防和治療疾病的目的。
核酸疫苗是利用現代
生物技術免疫學、
生物化學、
分子生物學等研製成的,分為DNA疫苗和RNA疫苗兩種。但目前對核酸苗的研究以DNA疫苗為主。
DNA疫苗又稱為裸疫苗,因其不需要任何化學載體而得此名。DNA疫苗導入宿主體內後,被
細胞(組織細胞、抗原遞呈細胞或其它炎性細胞)攝取,並在細胞內表達病原體的蛋白質抗原,通過一系列的反應刺激機體產生細胞免疫和體液免疫。
產生
核酸疫苗的發展史真正開始於20世90年代。
在過去的20世紀中,疫苗研究取得了巨大成功,它是繼
柯赫、
巴斯德等人的科學突破而迅速發展起來的,經歷了一個由“期盼”到“實現”這樣一個偉大的歷史轉變過程。疫苗免疫接種所經過的第一次重大變革是由Pasteur等研製開發的減毒或滅活的疫苗,第二次是使用完整生物體的天然成分即亞單位疫苗。它們雖然在一定程度上提高了免疫效應,但安全性不夠,尤其是對
免疫功能低下患者的風險較大。為此,人們進行了大量的試驗。
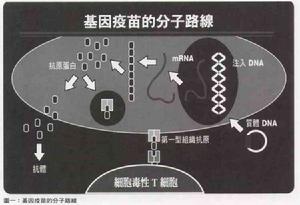 基因疫苗的分子路線
基因疫苗的分子路線1990年wolff等偶然發現給小鼠肌肉注射外源性重組質粒後,質粒被攝取並能在體內至少兩個月穩定地表達所編碼蛋白。
1991年Williams等發現外源基因輸入體內的表達產物可誘導產生免疫應答。
1992年Tang等將表達人生長激素的基因質粒DNA導入小鼠皮內,小鼠產生特異性抗體,從而提出了基因免疫的概念。
1993年Ulmer等證實小鼠肌肉注射含有編碼甲型流感病毒核蛋白(NP)的重組質粒後,可有效地保護小鼠抗不同亞型、分離時間相隔34年的流感病毒的攻擊。隨後的大量動物實驗都說明在合適的條件下,DNA接種後既能產生細胞免疫又能引起體液免疫。因此,1994年在日內瓦召開的專題會議上將這種疫苗定名為核酸疫苗。
優勢
與傳統的滅活疫苗、亞單位疫苗和基因工程疫苗相比,核酸疫苗具有如下優點:1 免疫保護力增強
接種後蛋白質在宿主細胞內表達,直接與組織相容性複合物MHCI或II類分子結合,同時引起
細胞和體液免疫,對慢性病毒感染性疾病等依賴細胞免疫清除病原的疾病的預防更加有效。
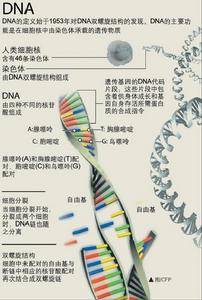 DNA
DNA2 製備簡單,省時省力
核酸疫苗作為一種重組質粒,易在工程菌內大量擴增,提純方法簡單,且可將編碼不同抗原基因的多種重組質粒聯合套用,製備多價核酸疫苗,這樣可大大減少人力、物力、財力以及多次接種帶來的應激反應。
3 同種異株交叉保護
這是基因疫苗的最大優點之一。在製備基因
疫苗時,可通過對基因表達載體所攜帶的靶基因進行改造,從而選擇抗原決定簇。
4 套用較安全
接種核酸疫苗後,蛋白質抗原在宿主細胞內表達,無因毒力返祖或殘留毒力病毒顆粒而引發疫病的危險,也不會引起對機體的不良反應。
5 產生持久免疫應答
免疫具有持久性,一次接種可獲得長期免疫力,無需反覆多次加強免疫。Wolff等報導,在注射後19個月仍可檢測到外源基因相當數量的表達。
6 貯存、運輸方便
核酸疫苗的質粒DNA穩定性好,便於貯存和運輸,無須冷藏。
7 可用於防治腫瘤
CTL應答也是機體殺死癌變細胞的有效清除途徑。若能找到在細胞惡性轉化過程中的關鍵蛋白,就能製備腫瘤的CTL疫苗。該基因疫苗接種後,可誘發機體產生CTL免疫應答,對細胞的惡變進行免疫監視,對癌變的細胞產生免疫應答,從而為癌症的預防和免疫治療提供強有力的新式武器。
潛在危險
1 質粒DNA可能誘導自身免疫反應,但是人和動物的許多試驗表明質粒DNA誘發自身免疫性疾病的可能性較小。目前已有一項DNA疫苗的接種研究表明,免疫動物血清中未檢測到抗DNA
抗體。但在DNA疫苗的臨床試驗中。應對接種者進行抗DNA抗體檢測。
2 持續表達外源抗原可能產生一些不良後果。質粒長期過高水平地表達外源抗原,可能導致機體對該抗原的免疫耐受或麻醉。在成年動物,尚未見到因DNA疫苗接種而誘發免疫耐受的例子。但新生動物的免疫系統尚未成熟,可能將外源抗原認為自己成分而形成耐受。另外,持續低水平表達的抗原可能會被血中的中和抗體清除,不能引起足夠的免疫應答,從而使疫苗的預防作用得不到充分的體現。
 核酸疫苗
核酸疫苗3 肌肉注射質粒後,僅有很少部分被肌細胞所攝取,反覆用PCR技術檢查血中質粒,結果為陰性,揭示肌注後逸入血流的疫苗質粒數量是微不足道的,質粒去向如何尚待進一步闡明。
4 影響核酸疫苗誘發機體免疫應答的因素很多,目前已知的主要有載體設計、核酸疫苗的導入方法、佐劑及輔助因子會對其免疫效果有影響。另外年齡和性別因素、肌注劑量和體積、預先注射蔗糖溶液等都會對肌注質粒DNA表達有影響。
5外源DNA注入體內後,可能整合到宿主
基因組上,使宿主細胞
抑癌基因失活或
癌基因活化,使宿主細胞轉化成癌細胞,這也許是核酸疫苗的諸多安全性問題中最值得深入研究的地方。Whalen等認為:通常用於實驗核酸免疫的劑量(100ug質粒)相當於1013拷貝,當注入肌肉後,絕大部分被降解和清除,但此問題仍待進一步研究證明。
免疫機理
核酸疫苗的免疫機理主要可以歸納為以下幾點:
1 核酸疫苗是近年發展的一種核酸介導的免疫接種疫苗,其本質是含有病原體抗原基因的真核表達載體當它被導入機體後,可被機體細胞所攝取並表達病原體的抗原蛋白,從而誘發機體對該蛋白的免疫反應。隨著導入途徑和部位的不同可引發全身或局部的免疫反應。在全身性的免疫應答反應中,既可激活體液免疫,也可誘發細胞免疫。
2 核酸疫苗可以引發全面的免疫應答
當帶有高效表達調控序列的保護性抗原基因導入動物體細胞(任何有核細胞)後,只有少量被細胞攝取而進入細胞核,在載體上的啟動子調控下,轉錄出抗原基因mRNA,後者進入胞漿而轉譯出相應的抗原蛋白。
 機理試驗
機理試驗抗原呈幾種方式而呈遞到
免疫系統:①抗原在細胞內經加工後與MHCI分子結合呈遞到細胞表面,刺激細胞毒性T淋巴細胞(CTL);②蛋白質從細胞中釋放出來與B細胞受體結合,刺激B細胞;③部分釋放出的蛋白質被抗原呈遞細胞所吸收、降解,然後與MHCII分子結合後刺激輔助性T細胞,最終引發了免疫系統的回響。免疫系統的回響程度,它與不同的免疫部位、細胞的表達程度和是否增加免疫調節基因有關。
3 核酸疫苗還可誘發局部的免疫應答和免疫記憶
如果用基因槍將包裹有
核酸疫苗的金顆粒導入黏膜下,即可能被黏膜下豐富的黏膜相關
淋巴組織中的淋巴細胞或黏膜上皮細胞攝取並表達,產生的抗原蛋白也很容易被局部豐富的抗原提呈細胞(APC)識別、攝取、加工並提呈給TH細胞,進一步激活局部淋巴濾泡中的B細胞分化為漿細胞和Bm細胞,後者產生免疫記憶,前者可合成IgA,且兩個IgA單體有J鏈連線在一起,通過黏膜時,由黏膜上皮細胞產生的分泌片與雙體IgA連線,組成穩定的分泌型IgA隨黏膜分泌液一起排出細胞,分布於黏膜表面,在黏膜局部防禦感染中起十分重要的作用。
4 近年來發現細菌DNA本身也是一種免疫佐劑,可有效地激活免疫效應細胞
介導這一作用是一類具有特徵性的短核苷酸序列,被稱為免疫刺激DNA序列。ISS的發現以及對其生物學功能研究的不斷深入,擴展了人們對DNA生物學的新認識。有學者認為,對ISS的研究有望提供一種高效、低毒、適用於
人類及
動物的新型佐劑。
5 還有人認為DNA免疫時,肌細胞和抗原提呈細胞(APC)均被轉染,引起CD4+、CD8+T細胞亞群的同時活化,產生了特異性免疫應答。肌肉細胞如何吸收質粒DNA,機制尚不明確。有人提示可能與骨骼肌纖維有豐富的含多處內折的T小管系統有關,其獨特的解剖結構有助於質粒DNA的吸收。
影響因素
質粒載體和啟動子的選擇
真核表達質粒是
核酸疫苗的主體,表達載體表達抗原蛋白的能力越強,誘發宿主產生的免疫應答能力越強。不同類型的啟動子/增強子、內含子序列、翻譯起始序列、轉錄終止序列、mRNA的穩定性等調控元件可直接影響基因表達效率,其中啟動子是影響核酸疫苗表達的最重要因素。RSV啟動子/增強子的表達水平比SV高1000倍,CMV啟動子/增強子的表達水平又比RSV高2倍。一般認為CMV是最理想的啟動子。強啟動子可以產生較好的免疫應答,但弱啟動子可能誘導長期的持續性免疫應答。總之,要求用作核酸疫苗的載體必須具備以下特點:在
哺乳動物細胞內能高水平的表達目的基因;本身不複製;不會整合到宿主染色體中。
注射途徑與方法
核酸疫苗免疫接種的方法主要分為三種:①可產生高轉染效率的途徑,如肌肉接種;②轉染效率雖不高,但是經常被用於實驗動物接種的途徑,如皮下、腹腔內接種;③轉染效率不高,但有高水平的局部免疫監視,如皮膚、呼吸道接種。一般地,用注射器直接注射要求DNA為10~200ug槍注射要求的DNA量可少至亞納克級。Frnan用50~100ug甲型流感病毒血凝素(HA因的純DNA於0及4周各接種一次小鼠,比較了不同的注射途徑和方法對核酸疫苗的免疫效果的影響。結果發現靜脈內、腹腔內和肌肉內合併免疫及單獨
肌肉內、
靜脈內、鼻腔內、皮內、腹腔內和皮下免疫的各組存活率分別為95%、95%、83%、76%、75%、67%和0。說明多種途徑合併注射免疫效果最好,其它依次為肌肉內、靜脈內、鼻腔內、皮內和皮下接種。隨著技術的發展,目前最為有效的核酸疫苗免疫途徑是使用基因槍將DNA包被的金顆粒注入表皮。這種方法只需比普通注射法低2~3個數量級的DNA,即0.4ugDNA免疫2次即可產生95%的保護作用。Hui等首先報導了基因槍轉染法誘導細胞介導的免疫應答。他們以1~2KbMHC抗原基因通過外科手術暴露小鼠
靶細胞後進行肌肉或脾內接種,結果產生了同樣特異的CTL應答。基因槍技術使有效的轉染與有效的抗原提呈和識別相結合。DNA包被的金顆粒射入表皮後,DNA隨之提呈細胞(
APC)。此外,一些學者報導,用無針噴氣注射器的免疫效果明顯,優於常規注射器免疫。這種裝置以壓縮空氣驅動活塞,高壓下使接種物形成細流而穿過組織。臨床上已被用於肌注傳統疫苗及皮下接種藥物(胰島素)。以此法注射含報告基因的質粒後可測出報告基因的表達,雖然僅及肌注表達水平的1/10,但能同時產生針對抗原的抗體和CTL。
接種部位的預處理
Davis等報告,試驗組小鼠免疫前肌肉注射100ul10mmol/L心肌毒素,對照組注射高滲蔗糖(25%W/V,用PBS溶解),然後兩組分別接種等量HBsAgDNA疫苗。結果試驗組抗~HBs水平較對照組高10倍以上。Danko等報告,在DNA接種前7天注射0.5%~0.75%丁哌卡可使外源基因的表達提高40倍以上,它能選擇性地破壞肌細胞,引起肌細胞再生,而再生肌細胞表達外源DNA的能力高於成熟肌細胞。
接種劑量與次數
核酸疫苗的特點是在體內的表達量低,但是持續時間長。核酸疫苗在動物或臨床試驗中的免疫程式一般都是3次,大動物或人體的接種量一般為500~1000ug。多數加強免疫在小動物中可以達到增強免疫應答和獲得理想免疫保護效果的目的。Ulmer等報告,給小鼠分別注射1~100ug
甲型流感病毒HA或NP DNA疫苗,結果抗~HA和抗~NP水平與接種劑量呈正相關。
免疫佐劑
免疫佐劑指與抗原同時或預先套用,能增強機體針對抗原的免疫應答能力,或改變免疫應答類型的物質,包括無機佐劑(如氫氧化鋁)、有機佐劑(如脂多糖、分支桿菌)及合成佐劑穴如雙鏈多聚肌苷酸,胞苷酸眼。近年來隨著細胞因子研究的進展,發現許多
細胞因子也具有明顯的免疫佐劑效應,能增強特異抗原的
免疫原性或增強機體對抗原的反應性,這些細胞因子包括IL-1、IL-2、IFN-r、GM-CSF、IL-6、 IL-12等。Weiner等用包含CpG序列(質粒骨架中含CpG序列)的DNA作為免疫佐劑和一種淋巴瘤抗原共同免疫小鼠,發現免疫後小鼠能抵抗攻毒試驗,而且CpG佐劑的毒性遠低於完全福氏佐劑,另外,CpG佐劑也能顯著提高抗腫瘤單克隆抗體在小鼠中的抗腫瘤效果。
套用現狀
有關質粒DNA疫苗在人類及動物產生預防和治療作用的研究報導不斷增加,套用範圍也逐漸擴大。人們期望用核酸疫苗來征服諸如微生物感染性疾病、
寄生蟲病等頑症,並用於腫瘤、遺傳病和其他多種疾病的基因水平治療,所以作了多方面的嘗試。
非病毒微生物感染性疾病的核酸疫苗
非病毒微生物感染時,非病毒微生物蛋白都由微生物本身表達,而不是被宿主細胞表達,因此核酸疫苗免疫後,在真核細胞內表達的非病毒微生物蛋白有可能產生不同類型的非自然感染狀態下的蛋白。但是迄今為止,許多實驗表明,向動物體內注射編碼非病毒微生物蛋白的核酸疫苗後,非病毒微生物蛋白可在注射部位原位表達,引發保護動物免受非病毒微生物攻擊的免疫反應。目前,用於防治非病毒微生物引起的疾病主要有
結核病、肺炎支原體感染、肺炎球菌感染、幽門螺旋桿菌感染、破傷風桿菌感染、布魯桿菌感染、沙眼衣原體感染、考德里立克次體感染、萊姆病等。但是從目前的試驗結果來看,核酸疫苗的預防療效還存在著種種不足,尚進一步研究闡明。
寄生蟲核酸疫苗
寄生蟲所致疾病種類多、分布廣、危害大。抗寄生蟲感染是一個世界性的問題,但是由於蟲體的抗藥性,以及現有各種寄生蟲疫苗存在的種種尚難解決的問題,寄生蟲病還不能有效地進行防治。但是,核酸疫苗的出現給人類抗寄生蟲感染帶來了新的希望。迄今為止,主要開展了針對
瘧原蟲、利氏曼原蟲、
血吸蟲及
囊蟲病核酸疫苗的研究,取得了一定效果。
腫瘤核酸疫苗
腫瘤是機體中正常細胞在各種致瘤因素的長期影響和作用下,發生過度增生和異常分化所形成的新生物,通常表現為腫塊。隨著人類對腫瘤認識的加深,
DNA疫苗開始套用於腫瘤的預防和治療,而且偏重於治療,在這個意義上腫瘤的核酸疫苗同時又是核酸藥物。目前,隨著研究的發展,DNA疫苗為治療惡性腫瘤提供了新的思路,主要有:①激發免疫系統殺死致癌病毒;②激發免疫系統識別並消除表達共同癌細胞信號的
癌細胞;③轉染和表達基因工程蛋白,從而使癌細胞成為更好的免疫靶子。將編碼腫瘤相關抗原的基因轉導到腫瘤細胞內表達,可提高腫瘤的免疫原性,從而增強宿主抗腫瘤的免疫應答。
發展前景
核酸疫苗的研究只是近十幾年發展起來的一項新的
生物技術,它已成為疫苗研究領域中的熱點之一,特別是其研究方向與世界衛生組織兒童疫苗計畫的長遠目標(用一種疫苗預防多種疾病)相吻合。現在已獲得了迅速的發展。它的研究具有深遠意義,可用於
細菌、
病毒、寄生蟲等多種疾病的防治,其多價、高效、廉價等優點使其潛在的套用價值不可估量。核酸疫苗可能對人類疾病的防治以及畜牧業的健康發展起到劃時代的作用。
目前,人們對核酸疫苗的研究日益深入,其中
愛滋病和
T細胞淋巴瘤的核酸疫苗已進入了臨床前階段,前列腺癌、肺癌、乳腺癌等核酸疫苗也正處於研究階段。美國FAD已批准B肝疫苗等10餘種DNA疫苗進入
臨床試驗,這預示核酸疫苗在21將成為人類和動物與各種疾病抗爭的有利武器,也顯示出核酸疫苗的巨大潛力和套用前景。
但是,人們對DNA免疫的作用機理和如何提高免疫水平仍然需要進一步研究。如外源DNA進入體內後,就無法認定控制其免疫途徑,外源DNA在體內各器官是否表達,攝入DNA後如何進行抗原呈遞?如何增強其免疫應答水平?同時DNA疫苗的構建以及生產方面還存在需要改進的地方。儘管核酸疫苗接種後引進的宿主細胞發生惡性轉化的可能性很少,但在短期內很難代替目前大量使用的傳統疫苗。
總之,核酸疫苗的未來研究方向是要朝著理想疫苗的方向發展,即從
疫苗本身的角度出發,要朝向“原始疫苗的方向”發展,即注重個性,得到全息多表位的疫苗,還要注重載體及佐劑的研究。為此,要尋求病毒粒子中與致病力密切相關的安全性問題能夠得到解決,再加上目前最有效的基因免疫接種方法——基因槍疫苗接種能夠解決注射疫苗的費時、費力和需要反覆注射(特別是對於動物)等問題,那么核酸疫苗就會成為疫苗的新希望,可能導致疫苗領域的一場革命。
 基因疫苗的分子路線
基因疫苗的分子路線 DNA
DNA 核酸疫苗
核酸疫苗 機理試驗
機理試驗
 基因疫苗的分子路線
基因疫苗的分子路線 DNA
DNA 核酸疫苗
核酸疫苗 機理試驗
機理試驗