基本介紹
- 中文名:核內電子
- 外文名:Nuclear electron
- 中子數:即核內電子數
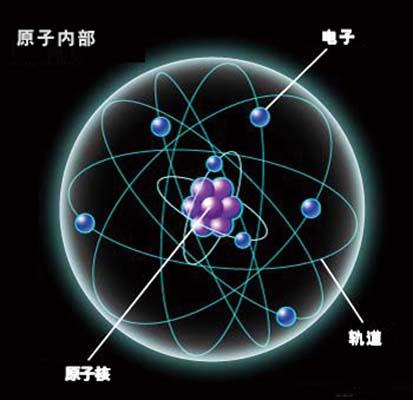
原子核是由質子和中子組成的,中子和質子的組成比必須在一定的範圍內才能保持核子的相對穩定,才不具有放射性。 如果認為原子是由質子和核外電子組成,核內不存在中子...
電子數,就是電子的數量。電子是一種基本粒子,在化學中,電子數一般是指原子或離子的核外電子的數目。...
與電子電性相反的粒子被稱為正電子,它帶有與電子相同的質量,自旋和等量的正電荷。電子在原子內做繞核運動,能量越大距核運動的軌跡越遠,有電子運動的空間叫電子...
非常雜亂的運動,並且是高速運動.但都被約束在一個電子層內.它是在電子中無規律運動的物質,經常用於技術開發當中,是一種很好的轉換物質,有電子和質子。...
電子是一種微觀粒子,在原子如此小的空間(直徑約10⁻¹⁰m)內運動,核外電子的運動與巨觀物體運動不同,沒有確定的方向和軌跡,只能用電子雲描述它在原子核外...
非常雜亂的運動,並且是高速運動.但都被約束在一個電子層內.它是在電子中無規律運動的物質,經常用於技術開發當中,是一種很好的轉換物質,有電子和質子。...
表示原子核外電子排布的圖式之一。有七個電子層,分別用1、2、3、4、5、6、7等數字表示K、L、M、N、O、P、Q等電子層,用s、p、d、f等符號分別表示各...
由玻爾的理論發展而來的現代量子物理學認為原子核外電子的可能狀態是不連續的,因此各狀態對應能量也是不連續的。這些能量值就是能級。能級是用來表達在一定能層上(K...
軍用核電子儀器(military nuclear electronic instrument )是為完成核監測和輻射防護任務而裝備軍隊的電子儀器。這類核電子學儀器包括:①軍用核輻射劑量探測儀器;②核...
“核電子秤”是水泥生產設備中的重要部件,承擔著計量任務。“核電子秤”中含有“銫-137”,它是一種有毒的放射性物質,該物質遇到水時會發生劇烈爆炸。核電子秤...
電子核(Electronic core)自2000千禧年的“NWOAHM美國新浪潮金屬運動”之後,07年開始至今出現了許多年輕的新生代後核團體,他們在以EMO-core(情緒硬核)作為主體元素的...
利用核輻射與物質的相互作用及其在物質中的傳播規律測量物質的厚度、密度等參數的儀器。這類核電子儀表在工業上可用於產品質量檢驗,也可在生產流程中用作自動控制的...
「電子龍核」是遊戲王的怪獸卡。「電子龍卡組」重要的「電子」魔陷檢索源,卡名帶有「電子龍」欄位,同時也是「電子龍」的卡名替代品之一。...
金屬原子的外層電子數目一般較少,原子核對它們的吸引力較弱。當金屬原子結合成為金屬晶體時,外層電子即脫離母原子成為自由電子。許許多多自由電子形成電子雲(或電子...
(皮米),但通常以半徑記錄,在以毫米(mm)為單位的情況下,直徑為1.4X10^-7mm,是由位於原子中心的原子核和一些微小的電子組成的,這些電子繞著原子核的中心運動,...
預報核是指企業在正式報核前,將本核銷期內申報的所有的電子賬冊進出口報關單按海關要求的內容(包括報關單號、進出口岸、核扣方式、進出標誌等)以電子報文方式向...
原子核(atomic nucleus)位於原子的核心部分,占了99.96%以上原子的質量,與周圍圍繞的電子組成原子。原子核由質子和中子構成。而質子又是由兩個上夸克和一個下夸克...
