技術 真核生物的
基因組DNA 以染色質的形式存在。因此,研究蛋白質與DNA在染色質環境下的相互作用是闡明真核生物基因表達機制的基本途徑。染色質免疫沉澱技術(chromatin immunoprecipitation assay, CHIP)是目前唯一研究體內DNA與蛋白質相互作用的方法。它的基本原理是在
活細胞 狀態下固定蛋白質-DNA複合物,並將其隨機切斷為一定長度範圍內的染色質小片段,然後通過免疫學方法沉澱此複合體,特異性地富集目的蛋白結合的DNA片段,通過對目的片斷的純化與檢測,從而獲得蛋白質與DNA相互作用的信息。CHIP不僅可以檢測體內反式因子與DNA的動態作用,還可以用來研究
組蛋白 的各種
共價修飾 與基因表達的關係。而且,CHIP與其他方法的結合,擴大了其套用範圍:CHIP與基因晶片相結合建立的CHIP-on-chip方法已廣泛用於特定反式因子靶基因的
高通量篩選 ;CHIP與
體內足跡法 相結合,用於尋找反式因子的體內結合位點;RNA-CHIP用於研究RNA在
基因表達調控 中的作用。由此可見,隨著CHIP的進一步完善,它必將會在基因表達調控研究中發揮越來越重要的作用。
染色體免疫共沉澱(Chromatin Immunoprecipitation,ChIP)是基於體內分析發展起來的方法,也稱結合位點分析法,在過去十年已經成為
表觀遺傳信息 研究的主要方法。這項技術幫助研究者判斷在
細胞核 中基因組的某一特定位置會出現何種
組蛋白修飾 。ChIP不僅可以檢測體內反式因子與DNA的動態作用,還可以用來研究組蛋白的各種共價修飾與基因表達的關係。近年來,這種技術得到不斷的發展和完善。採用結合微陣列技術在染色體基因表達調控區域檢查染色體活性,是深入分析癌症、心血管疾病以及中央神經系統紊亂等疾病的主要通路的一種非常有效的工具。
原理 檢測目標基因活性
在保持組蛋白和DNA聯合的同時,染色質被切成很小的片斷,通過運用對應於一個特定組蛋白標記的生物抗體,將目標片段(組蛋白發生特異標記的片段)沉澱下來。IP是利用
抗原 蛋白質和抗體的特異性結合以及細菌蛋白質的“protein A”特異性地結合到免疫球蛋白的FC片段的現象活用開發出來的方法(免疫磁珠結合proteinA,proteinA結合抗體Fc段,抗體結合抗原即發生特異標記的組蛋白,這裡要注意組蛋白是和DNA結合的,這樣就把目標組蛋白和DNA的符合物沉澱下來了)。在將組蛋白與DNA分離,用獲得的DNA去做
western blot ,從而檢測那些基因的組蛋白發生了修飾。
檢測已知蛋白的靶基因
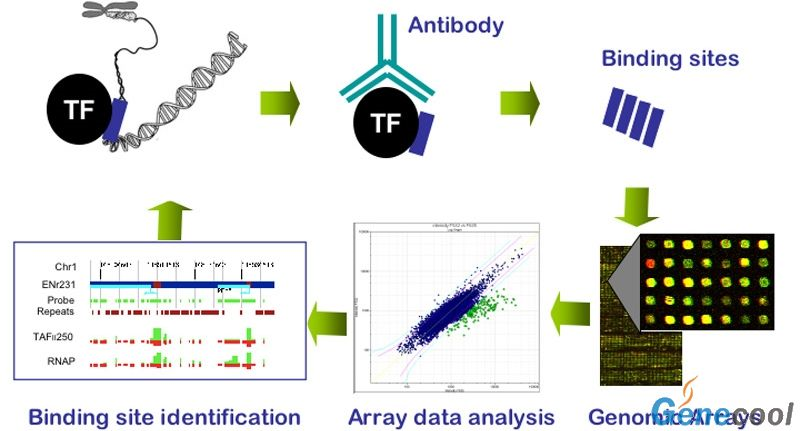
在生理狀態下把細胞內的蛋白質和DNA交聯在一起,超音波將其打碎為一定長度範圍內的染色質小片段,然後通過所要研究的目的蛋白質特異性抗體沉澱此複合體,特異性地富集目的蛋白結合的DNA片段,通過對目的片斷的純化與檢測,從而明確蛋白與哪些基因相互作用。
目前多用精製的protein A預先結合固化在argarose的beads上,使之與含有抗原的溶液及抗體反應後,beads上的prorein A就能吸附抗原達到精製的目的。實驗最需要注意點就是抗體的性質。抗體不同和抗原結合能力也不同,免染能結合未必能用在IP反應。建議仔細檢查抗體的說明書。特別是多抗的特異性是問題。其次,要注意溶解抗原的緩衝液的性質。多數的抗原是細胞構成的蛋白,特別是骨架蛋白,緩衝液必須要使其溶解。為此,必須使用含有強界面活性劑的緩衝液,儘管它有可能影響一部分抗原抗體的結合。另一面,如用弱界面活性劑溶解細胞,就不能充分溶解細胞蛋白。即便溶解也產生與其它的蛋白結合的結果,抗原決定族被封閉,影響與抗體的結合,即使IP成功,也是很多蛋白與抗體共沉的悲慘結果。再次,為防止蛋白的分解,修飾,溶解抗原的緩衝液必須加蛋白每抑制劑,低溫下進行實驗。每次實驗之前,首先考慮抗體/緩衝液的比例。抗體過少就不能檢出抗原,過多則就不能沉降在beads上,殘存在上清。緩衝劑太少則不能溶解抗原,過多則抗原被稀釋。
一般流程 ChIP的一般流程:
甲醛 處理
細胞 ---收集細胞,超聲破碎---加入目的
蛋白 的抗體,與靶蛋白-
DNA 複合物相互結合---加入ProteinA,結合抗體-靶蛋白-DNA複合物,並沉澱---對沉澱下來的複合物進行清洗,除去一些非特異性結合---洗脫,得到富集的靶蛋白-DNA複合物---解交聯,純化富集的DNA-片斷---PCR分析。
在PCR分析這一塊,比較傳統的做法是半定量-PCR。但是現在隨著
螢光定量PCR 的普及,大家也越來越傾向於Q-PCR了。此外還有一些由ChIP衍生出來的方法。例如RIP(其實就是用ChIP的方法研究細胞內蛋白與RNA的相互結合,具體方法和ChIP差不多,只是實驗過程中要注意防止
RNase ,最後分析的時候需要先將RNA
逆轉錄 成為cDNA);還有ChIP-chip(其實就是ChIP富集得到的DNA-片段,拿去做
晶片 分析,做法在ChIP的基礎上有所改變,不同的公司有不同的做法,要根據公司的要求來準備樣品)。
具體操作流程:
第一天:
(一)、細胞的甲醛交聯與超聲破碎。
1、取出1平皿細胞(10cm平皿),加入243 ul 37%甲醛,使得甲醛的終濃度為1%(培養基共有9ml)。
2、37攝氏度孵育10min。
3、終止交聯:加
甘氨酸 至終濃度為0.125M。450 ul 2.5M甘氨酸
於平 皿中。混勻後,在
室溫 下放置5min即可。
4、吸盡培養基,用冰冷的PBS清洗細胞2次。
5、細胞刮刀收集細胞於15ml
離心管 中(PBS依次為5ml,3ml和3ml)。預冷後2000rpm 5min收集細胞。
6、倒去上清。按照細胞量,加入SDS Lysis Buffer。使得細胞終濃度為每200ul含2×106個細胞。這樣每100ul溶液含1×106個細胞。再加入
蛋白酶抑制劑 複合物。假設MCF7長滿板為5×106個細胞。本次細胞長得約為80%。即為4×106個細胞。因此每管加入400ul SDS Lysis Buffer。將2管混在一起,共800ul。
7、超聲破碎:VCX750,25%功率,4.5S衝擊,9S間隙。共14次。
(二)、除雜及抗體哺育。
8、超聲破碎結束後,10000g 4℃離心10min。去除不溶物質。
留取300ul做實驗,其餘保存於-80℃。
300ul中,100ul加抗體做為實驗組;100ul不加抗體做為對照組;100ul加入4ul5MNaCl(NaCl終濃度為0.2M),65℃處理3h解交聯,跑電泳,檢測超聲破碎的效果。
9、在100ul的超聲破碎產物中,加入900ul ChIP Dilution Buffer和20ul的50×PIC。
再各加入60ul ProteinA Agarose/Salmon Sperm DNA。4℃顛轉混勻1h。
10、1h後,在4℃靜置10min沉澱,700rpm
離心 1min。
11、取上清。各留取20ul做為input。一管中加入1ul抗體,另一管中則不加抗體。4℃顛轉過夜。
(三)、檢驗超聲破碎的效果。
取100ul超聲破碎後產物,加入4ul 5M NaCl,65℃處理2h解交聯。分出一半用酚/氯仿抽提。
電泳 檢測超聲效果。
第二天:
(一)、免疫複合物的沉澱及清洗。
12、孵育過夜後,每管中加入60ul ProteinA Agarose/Salmon Sperm DNA。4℃顛轉2h。
13、4℃靜置10min後,700rpm離心1min。除去上清。
14、依次用下列
溶液 清洗沉澱複合物。清洗的步驟:加入溶液,在4℃顛轉10min,4℃靜置10min沉澱,700rpm離心1min,除去上清。
洗滌溶液:a.low salt wash buffer-one wash
b.highsalt wash buffer-one wash
c.LiCl wash buffer-one wash
d.TE buffer-two wash
15、清洗完畢後,開始洗脫。洗脫液的配方:100ul10%SDS,100ul 1MNaHCO3,800ul ddH2O,共1ml。
每管加入250ul洗脫buffer,室溫下顛轉15min,靜置離心後,收集上清。重複洗滌一次。最終的洗脫液為每管500ul。
16、解交聯:每管中加入20ul 5M NaCl(NaCl終濃度為0.2M)。
混勻,65℃解交聯過夜。
第三天:
(一)、DNA樣品的回收
17、解交聯結束後,每管加入1ul RNaseA(MBI),37℃孵育1h。
18、每管加入10ul 0.5MEDTA,20ul 1MTris.HCl(PH6.5),2ul 10mg/ml蛋白酶K。
45℃處理2h。
19、DNA片段的回收----omega膠回收試劑盒。最終的樣品溶於100ul ddH2O。
(二)、PCR分析
CHIP-seq 染色質免疫共沉澱技術(Chromatin Immunoprecipitation,ChIP)也稱結合位點分析法,是研究體內蛋白質與DNA相互作用的有力工具,通常用於
轉錄因子 結合位點或組蛋白特異性修飾位點的研究。將ChIP與第二代測序技術相結合的ChIP-Seq技術,能夠高效地在全基因組範圍內檢測與組蛋白、
轉錄因子 等互作的DNA區段。
ChIP-Seq的原理是:首先通過染色質免疫共沉澱技術(ChIP)特異性地富集目的蛋白結合的DNA片段,並對其進行純化與文庫構建;然後對富集得到的DNA片段進行高通量測序。研究人員通過將獲得的數百萬條序列標籤精確定位到基因組上,從而獲得全基因組範圍內與
組蛋白 、轉錄因子等互作的DNA區段信息。
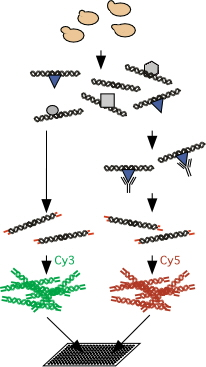
染色質免疫共沉澱-晶片(ChIP-chip) 實際上現在染色質免疫共沉澱通常都和
晶片技術 結合使用,實現大通量的篩選,在DNA與蛋白質分離後,以所獲得DNA片段為探針通過晶片去篩選
靶基因 。
ChIP與基因晶片相結合建立的ChIP-chip方法已廣泛用於特定反式因子靶基因的高通量篩選。它與DNA晶片和分子克隆技術相結合,可用於高通量的篩選已知蛋白質分析的未知DNA靶點和研究反式作用因子在整個基因組上的分布情況。染色質免疫共沉澱技術與晶片技術相結合更有助於科學家發明疾病的有效治療方法。調控蛋白與基因組DNA結合能夠控制DNA複製和基因表達,作為細胞調節網路中的開關,結合位點分析信息與基因表達數據相結合,將能有助於分析尋找生物標誌物(biomarker)。轉錄因子通過與核酸直接的相互作用等方式在細胞內發揮著重要的轉錄調控作用。它們通常序列特異性地結合在基因轉錄起始位點上游的啟動子區來調節該基因的轉錄。而ASB的啟動子晶片技術則是用於檢測單個轉錄因子在細胞中的某一時刻與20,000個基因啟動子相互作用的情況。通過染色質免疫共沉澱(ChIP)技術和啟動子晶片的有機結合,可以確定任何一個特定轉錄因子的靶基因群。
ChIP-chip技術對於大規模挖掘順式調控信息成績卓著,同時它可以用於胚胎幹細胞和一些疾病如癌症、心血管疾病和中央神經紊亂的發生的機制。研究人員還可以利用這項技術開發一些治療方法。目前ChIP-chip技術研究主要集中於兩個領域:及轉錄因子的結合和條件特異性;組蛋白的修飾,組蛋白修飾蛋白和染色體重建。ChIP-chip 在描述轉錄結合因子動力學中的研究、染色體結構組分的分布、在組蛋白的修飾、組蛋白修飾蛋白和染色體重建中的套用也十分廣泛。ChIP-chip 技術的優點是,可以在體內進行反應;在給定的檢驗細胞環境的模式下得到DNA相互關係的簡單影像;使用特異性修正抗體鑑定與包含有一個特異性後轉錄修正的蛋白質的相關位點;直接或者間接(通過蛋白質與蛋白質的相互作用)的鑑別基因組與蛋白質的相關位點。缺點是:需要一個特異性蛋白質抗體,有時難於獲得;為了獲得高豐度的結合片段,必須實驗演示胞內條件下靶標蛋白質的表達情況;調控蛋白質的基因的獲取可能需要限制在組織來源中。總之,ChIP-chip 技術的發展為分析活細胞或組織中DNA與蛋白質的相互關係提供了一個極為有力的工具。在未來的研究中,將對晶片的構建進行改進,提高其實用性。使用易於獲得抗體,增加這種方法的可用性。
技術套用 該技術主要套用於:
1.組蛋白修飾酶的抗體作為“生物標記”
2.轉錄調控分析
3.藥物開發研究
4.有絲分裂研究
5.DNA損失與凋亡分析