簡介
組蛋白 組蛋白(histone)是指所有
真核生物 的細胞核中,與DNA結合存在的
鹼性蛋白質 的總稱。其分子量約10000~20000。
真核生物體細胞
染色質 中的鹼性蛋白質,含
精氨酸 和賴氨酸等
鹼性胺基酸 特別多,二者加起來約為所有胺基酸
殘基 的1/4。組蛋白與帶負電荷的雙螺旋DNA結合成DNA-組蛋白複合物。因
胺基酸 成分和分子量不同,主要分成5類。
組蛋白的甲基化修飾主要是由一類含有SET
結構域 的蛋白來執行的,組蛋白甲基化修飾參與異染色質形成、
基因印記 、
X染色體 失活和轉錄調控等多種主要生理功能,組蛋白的修飾作用是
表觀遺傳學 研究的一個重要領域。組蛋白甲基化的異常與腫瘤發生等多種人類疾病相關,可以
特異性 地激活或者
抑制基因 的轉錄活性。研究發現,組蛋白
甲基轉移酶 的作用對象不僅僅限於組蛋白,某些
非組蛋白 也可以被組蛋白甲基轉移酶甲基化,這將為探明細胞內部
基因轉錄 、信號轉導、甚至個體的發育和分化機制提供更廣闊的空間。
概述 組蛋白的基因非常保守。親緣關係較遠的種屬中,四種組蛋白(H2A、H2B、H3、H4)胺基酸序列都非常相似,如海膽組織H3的胺基酸序列與來自小牛胸腺的H3的胺基酸序列間只有一個胺基酸的差異,小牛胸腺的H3的胺基酸序列與豌豆的H3也只有4個胺基酸不同。不同生物的H1序列變化較大,在某些組織中,H1被特殊的組蛋白所取代。如成熟的魚類和鳥類的紅細胞中H1則被H5所取代,
精細胞 中則由精蛋白代替組蛋白。染色質中的組蛋白與DNA的含量之比為1:1。
組蛋白 真核生物細胞核中組蛋白的
含量 約為每克DNA 1克,大部分真核生物中有5種組蛋白,兩棲類、魚類和鳥類還有H5以替代或補充H1。染色質是由許多核小體組成的,H2A,H2B,H3和H4各2個分子構成的8聚體是核小體的核心部分,H1的作用是與線形 DNA結合以幫助後者形成高級結構。組蛋白是已知蛋白質中最保守的,例如,人類和豌豆的H4胺基酸序列只有兩個不同,人類和酵母的H4胺基酸序列也只有8個不同,這說明H4的胺基酸序列在約10^9年間幾乎是恆定的。早在1888年德國化學家科塞(A.Kossel)已從細胞核中分離出組蛋白,並認識到它們作為鹼性物質應在核中與核酸結合,但直到1974年才了解組蛋白的確切作用。一些實驗室隨後證明組蛋白以獨特的方式構成核小體的組分。
組成部分 組蛋白是存在於
染色體 內的與DNA結合的鹼性蛋白質,染色體中組蛋白以外的蛋白質成分稱非組蛋白。絕大部分非組蛋白呈酸性,因此也稱酸性蛋白質或剩餘蛋白質。組蛋白於1834年由德國科學家A.科塞爾發現。組蛋白對染色體的結構起重要的作用。染色體是由重複單位──核小體組成。每一核小體包括一個核心8聚體(由4種
核心組蛋白 H2A、H2B、H3和H4的各兩個
單體 組成);長度約為200個鹼基對的
脫氧核糖核酸 (DNA);和一個單體組蛋白H1。長度為147鹼基對的DNA盤繞於核心8聚體外面。在核心8聚體之間則由長度約為60個鹼基對的DNA連線。這種DNA稱為“接頭”DNA。
組蛋白 幾乎所有
真核細胞 染色體的組蛋白均可分成5種主要的組分,分別用字母或數字命名,命名方法也不統一,如H1或稱F1,Ⅰ;H2A或稱F2A2,Ⅱb1;H2B或稱F2B,Ⅱb2;H3或稱F3,Ⅲ;H4或稱F2A1,Ⅳ。有核的紅細胞或個別生物體中,還存在特別的組蛋白成分,紅細胞中為H5或F2C,Ⅴ,鮭魚組織中為H6或T。H2A、H2B、H3、H4組成核小體的核心,也稱核心組蛋白。根據組蛋白的
一級結構 ,又可將它們分為3種類型:賴氨酸含量特別豐富的組蛋白(H1);賴氨酸含量較豐富的組蛋白(H2A和H2B);精氨酸含量豐富的組蛋白(H3和H4)。從整體來說,組蛋白在進化過程中
保守性 很強。其中H1變化較大,H3和H4變化最小。如對小牛胸腺的5種組蛋白,豌豆苗組蛋白的H3、H4和兔胸腺組蛋白H1等的一級結構比較中發現,小牛胸腺和豌豆苗的組蛋白H4間只在60位和77位上的兩個胺基酸殘基不同。但已知的真菌和原生動物的組蛋白的部分一級結構和動、植物的組蛋白間的差異較大。
合成修飾 這是形成組蛋白各組分微不均一性的主要原因。修飾的方式有:
一種是H1、H2A、H4組蛋白的氨基末端乙醯化,形成α-乙醯絲氨酸,組蛋白在細胞質內合成後輸入細胞核之前發生這一修飾。
另一種是在H2A、H2B、H3、H4的氨基末端區域的某些專一位置形成N6-乙醯賴氨酸。
②
磷酸化 。所有組蛋白的組分均能磷酸化,在
細胞分裂 期間,H1的1~3個絲氨酸可以磷酸化。而在有絲分裂時期,H1有3~6個絲氨酸或蘇氨酸發生磷酸化,其他四個核心組蛋白的磷酸化可以發生在氨基末端區域的絲氨酸殘基上。組蛋白的磷酸化可能會改變組蛋白與DNA的結合。
③甲基化。僅發現於H3的9和27位和H4的20位的賴氨酸,鴨紅細胞組蛋白H1和H5的組氨酸。
④ADP-
核糖 基化。組蛋白H1、H2A、H2B及H3和多聚ADP-核糖的共價結合,ADP-核糖基化被認為是在真核細胞內啟動複製過程的扳機。
⑤其他修飾:賴氨酸的丙醯化、丁醯化、琥珀醯化、巴豆醯化、
丙二酸 醯等。
H3·H4的乙醯化可打開一個開放的染色質結構,增加基因的表達。轉錄共同激活物如CBPöP300、PCAF實質上是體內的組蛋白乙醯基轉移酶(HAT)。相反,HDAC參與組成轉錄共同抑制複合物,已發現的兩個共同抑制複合物SIN3、Mi22NHRD(核小體重塑蛋白去乙醯基酶)都含有HDAC1、HDAC2。SIN3的組成為核心(HDAC1、HDAC2、RBAP46öRBAP48)SIN3AöSIN3B、SAP30öSAP18共同構成。
SIN3複合物通過組分SIN3A與
序列特異性轉錄因子 或共同抑制物包括mael2max,核激素受體N2CORöSMRT、甲基化CPG粘附蛋白(MECP2、MBD2)相互作用。Mi22NHRD由核心(HDAC1、HDAC2、RBAP46öRBAP48)Mi2、MTA1öMTA2、MBD3組成,其中MBD3含有MBD樣序列,與甲基化DNA有低親和力,分析發現MBD3與甲基化有關的胺基酸被置換,由此推測MBD3與MBD2相互作用而使Mi22NURD與甲基化DNA結合。由此看出,
DNA甲基化 和組蛋白去乙醯化協同作用共同參與
轉錄阻遏 。
此外,Mi22NURD還有染色質重塑活性,所以SIN3和Mi22NURD可能分別在長期和短期轉錄阻遏調節中起作用。
在哺乳動物基因組中,組蛋白則可以有很多修飾形式.一個核小體由兩個H2A,兩個H2B,兩個H3,兩個H4組成的八聚體和147bp纏繞在外面的DNA組成.組成核小體的組蛋白的核心部分狀態大致是均一的,游離在外的N-端則可以受到各種各樣的修飾,包括組蛋白末端的乙醯化,甲基化,磷酸化,
泛素化 等等。
組蛋白被甲基化的位點是賴氨酸和精氨酸.賴氨酸可以分別被一、二、三甲基化,精氨酸只能被一、二甲基化.在組蛋白H3上,共有5個賴氨酸位點可以被甲基化修飾。
一般來說,組蛋白H3K4的甲基化主要聚集在活躍轉錄的啟動子區域。組蛋白H3K9的甲基化同基因的轉錄抑制及異染色質有關。EZH2可以甲基化H3K27,導致相關基因的沉默,並且與X-Chromosomeinactivation相關。H3K36的甲基化同基因轉錄激活相關。
成分 通常含有H1,H2A,H2B,H3,H4等5種成分。除H1外,其他4種組蛋白均分別以
二聚體 (共八聚體)相結合,形成
核小體 核心。DNA便纏繞在核小體的核心上。而H1則與核小體間的DNA結合。因此,一般認為組蛋白作為結構支持體的作用比其
基因 調節作用更為重要。鳥類、
兩棲類 等含有細胞核的
紅細胞 中,含有一種叫H5的特殊組蛋白。此外,在停止增殖的細胞中,還含有一種叫H1°的組蛋白,H1°的結構與H5相類似。組蛋白可受到
甲基化 、
乙醯化 、
磷酸化 、聚ADP核糖醯化,以及與
泛醌 (ubiquinone)相結合等幾種類型的修飾。組蛋白的修飾與染色質結構的變化及基因活性控制的相關性等等,是今後的重要研究課題。
分類特徵 種類
賴氨酸/精氨酸
殘基數
分子質量(kd)
保守性
存在部位及結構作用
H1
29.0
215
23.0
低
連線線上,鎖定核小體、參與包裝
H2A
1.22
129
14.0
高
核心顆粒,形成核小體
H2B
2.66
125
13.8
高
核心顆粒,形成核小體
H3
0.77
135
15.3
極高
核心顆粒,形成核小體
H4
0.79
102
11.3
極高
核心顆粒,形成核小體
H1富含鹼性胺基酸
醫學套用 預測 最新研究結果顯示:
組蛋白修飾 的整體模式可預測低分級
前列腺癌 的復發風險。該研究第一作者
加利福尼亞大學 的Siavash K. Kurdistani表示:這種修飾模式最終可作為
前列腺 或其他類型癌症的預後或診斷指標,也可作為預測何種患者、患者會對一類o組蛋白去乙醯酶抑制劑新藥產生反應的指標。Kurdistani解釋:某些組蛋白修飾模式會在一定水平上影響基因的表達,但具體機制尚不清楚。
Kurdistani等人研究了五種組蛋白修飾模式,包括3種乙醯化作用,2種二甲基化作用,用組織晶片技術對原發前列腺癌組織樣品中的組蛋白修飾水平進行檢測。
研究者對104例Gleason評分小於7的樣本進行染色組蛋白修飾檢測,結果將研究對象分為2組,第1組10年內復發危險為17%,第2組為42%。該預測指標與腫瘤分期,術前PSA水平或是否包膜外侵犯相獨立。
研究者對另外的39例低分級前列腺癌樣本的組蛋白修飾模式進行了確認,結果也分為2組,1組的復發危險為4%,另1組為31%。
研究者最後表示:考慮到組蛋白修飾模式的多樣性,其他組蛋白修飾位點的信息將有助於我們對患者進行進一步分類,包括那些高分極組的患者。套用免疫組化及越來越多的的抗體檢測組蛋白修飾將有助於這種檢測指標在其他腫瘤中的套用。
調控 組蛋白修飾與
基因表達調控 有關已經被廣泛的證明了。PierreEtchegary,StevenReppertandcoworkers的研究表明組蛋白修飾,特別是組蛋白乙醯化對於哺乳動物生物鐘的調控是非常重要的。
調控生物鐘的關鍵蛋白Clock和Bmal1驅動著三個period
基因 (Per1,2,3)和兩個細胞色素基因(Cry1,2)的表達。這5個基因的
轉錄本 覆蓋了生物24小時的時間。但奇怪的是Clock/Bmal1對Per
啟動子 的結合相對穩定,而它們對Cry1啟動子最強的結合卻反應著Cry1表達的最弱。在這篇文章中E發現是染色體結構的修飾來決定Per和Cry基因的轉錄的。
研究者用甲醛交連的染色體
免疫沉澱 CHIP和
半定量 的PCR反應的方法發現在Per1和Per2的啟動子上組蛋白3的乙醯化在全天都存在,而RNA多聚酶Ⅱ也一直被招募在這些啟動子上。當H3被乙醯化和RNA多聚酶Ⅱ結合最強時,Per轉錄本水平最高,這說明H3的乙醯化可能通過促進將RNA多聚酶Ⅱ招募到
啟動子 上而促進基因的轉錄。Cry
基因座位 的表達也有類似的相關性。
研究者發現具有
蛋白質乙醯化 活性的p300在小鼠肝細胞中能與Clock組成複合物。研究者認為白天p300/Bmal1/Clock結合在啟動子上,促進H3乙醯化,
RNA 多聚酶Ⅱ招募到啟動子上而Per基因發生轉錄。夜間p300與Bmal1/Clock進行解離,導致組蛋白的去乙醯化而
抑制基因 的轉錄。
那么,導致p300基因日夜節律的是什麼呢?
研究者發現是Cry對其進行負調控的結果,研究者發現Cry1,2抑制p300/Bmal1/Clock驅動的
基因轉錄 。他們認為可能是Cry對p300/Bmal1/Clock複合物進行去穩定性作用而對其功能進行抑制。乙醯化對
基因表達 的調控已經廣為人知,這個新的研究更讓人們確定組蛋白的乙醯化對基因表達的調控具有很廣泛的作用。
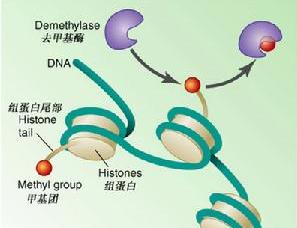 組蛋白
組蛋白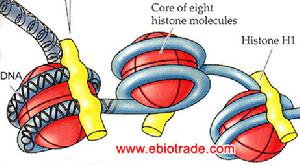 組蛋白
組蛋白
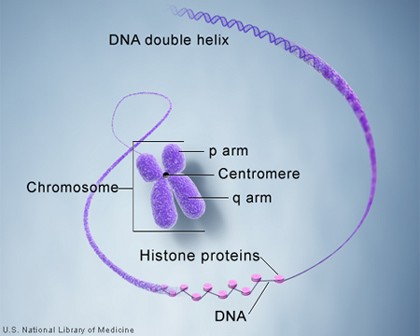 組蛋白
組蛋白