摩爾氣體常數
相關詞條
- 摩爾氣體常數
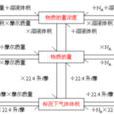
摩爾氣體常數(又稱通用、理想氣體常數及普適氣體常數,符號為R)是一個在物態方程式中連繫各個熱力學函式的物理常數。其值大約為8.31441±0.00026J/(mol·K)
- 理想氣體常數
又名:通用氣體常數,是一個在物態方程中連繫各個熱力學函式的物理常數。1n摩爾理想氣體在絕對溫度T,壓強P下,占有體積V則PV=nRT。此式稱為理想氣體的狀態方程,...
- R(摩爾氣體常數)
pV=nRT根據阿伏伽德羅定律,任何氣體,在同溫同壓下,相同體積中所含的分子數相等,所以R是對所有氣體都適用的普適常數。R=8.314J/(mol*K)...
- 基本物理常數
理想氣體摩爾體積 Vm 22.413996×10-3 m3/mol 1.7×10-6 基本電荷(元電荷) e 1.602176487×10-19 C 2.5×10-8 原子質量常數 mu 1.660538782×10-27...
- 摩爾定壓熱容
釋義公式表示為: 對於理想氣體,有: ,其中, 為氣體的摩爾定容熱容,R為摩爾氣體常數。 摩爾定壓熱容與溫度函式的關係,通常可以表示成如下的經驗公式: ; ...
- 氣體壓縮係數
其中,P是氣體的絕對壓力;vm是摩爾體積;Ru是通用氣體常數;R=Ru/M;R是氣體的摩爾氣體常數;T是熱力學溫度。Z偏離1越遠,氣體性質偏離理想氣體性質越遠。Z在實際...
- 氣體比熱容
分子的平動自由度對定容熱容的貢獻是而定容摩爾比熱容是(以下均指定容摩爾比熱容),R是摩爾氣體常數。②轉動部分。組成多原子分子的原子愈重或數量愈多,轉動慣量...
- 阿倫尼烏斯公式
k為速率常數,R為摩爾氣體常量,T為熱力學溫度,Ea為表觀活化能,A為指前因子(也稱頻率因子)。 該定律除對所有的基元反應適用外,對於一大批(不是全部)複雜反應...
- 阿累尼烏斯方程
k—溫度T時的反應速度常數,min-1;Ea—反應活化能,一般視為與溫度無關的常數,J·mol-1或·kJ·mol-1;T—絕對溫度,K; R—摩爾氣體常數,8.314J/mol·K。...
- 維里係數
當壓強趨於零(或體積趨於無窮大)時,A=RT(R是摩爾氣體常數),於是上面兩式就變成玻意耳-馬略特定律。各個維里係數都可由實驗測定。實驗表明,維里係數A、B、C...
- 相變熱
式中, 為熔化熱; 為正常熔點;R為摩爾氣體常數。相變熱升華熱的計算 升華熱一般可以看作是熔化熱與蒸發熱之和。相變熱測定方法 編輯 (1)直接量熱。例如在等...
- 量氣法
很多大學化學實驗教材中都有與量氣法相關的實驗內容,如置換法測定Mg的摩爾質量、摩爾氣體常數R的測定、氣體摩爾體積的測定、CaO2含量的分析、電解法測定阿伏伽德羅...
- 壓縮係數
其中,P是氣體的絕對壓力;vm是摩爾體積;Ru是通用氣體常數;R=Ru/M;R是氣體的摩爾氣體常數;T是熱力學溫度。Z偏離1越遠,氣體性質偏離理想氣體性質越遠。Z在實際...
- 指前因子
阿倫尼烏斯公式k=A·exp(-Ea/RT)中,k、R、T、Ea分別是化學反應速率常數、摩爾氣體常數、反應溫度及活化能,式中的A稱為指前因子。它是一個只由反應本性決定...
- 狀態方程(流體力學)
若只用強度性質來表達,則上式變為Vm=F(T,p),式中Vm是摩爾體積或比容。例如,理想氣體的狀態方程式是:pVm=RT,式中R是氣體常數。對實際氣體、液體和固體...
- 熱化學數據
式中ΔHm為熔化熱;Tm為正常熔點;R為摩爾氣體常數。 升華熱一般可以看作是熔化熱與蒸發熱之和。熱化學數據化學反應 編輯 化學反應熱 簡稱反應熱,是等溫下化學...
- 活化能
式中:κ為反應的速率系(常)數;Ea和A分別稱為活化能和指前因子,是化學動力學中極重要的兩個參數;R為摩爾氣體常數;T為熱力學溫度。...
- 表觀動力學
(即催化劑活性中心)的溫度和反應物Ⅰ的濃度有一定偏離,偏離的程度則取決於流動、傳熱、傳質等反應器傳遞過程;R摩爾氣體常數;Ao、Eo、no分別為表觀頻率因子、表觀...
